9.1. Литературная справка
Метод проточной цитометрии был впервые описан Кросландом- Тэйлором. Революционное предложение об исследовании содержания нуклеиновых кислот в ламинарном потоке клеток позволило анализировать десятки тысяч клеток за секунды. Под воздействием узкого луча ртутно-кварцевой лампы вызывалась флуоресценция красителя, количественно связанного с ДНК, интенсивность флуоресценции от каждой клетки регистрировалась, ответ выдавался в виде гистограммы, показывающей частотное распределение клеток, имеющих различную интенсивность флуоресценции. Метод позволял изучать плоидность клеток и их процентное распределение по фазам клеточного цикла. Совершенствование метода было направлено на создание лазерных ламп, обладающих монохромным лучом с большей плотностью энергии и высокой коллимацией; а также на использование новых приемов фиксации и окраски клеток.
Первоначальные попытки использования проточной цитометрии для диагностики злокачественных опухолей были безуспешны, принципиальным было препятствие, связанное с биологией опухолевых клеток: как оказалось, далеко не все они имеют патологический кариотип, значительная часть опухолей состоит из диплоидных клеток (175, 157, 68, 69 и др.). Одновременно было обнаружено, что данные, полученные при проточной цитометрии могут иметь прогностическое значение (68, 69, 117).
Последующими работами было показано влияние на течение РМЖ как показателей пролиферативной активности, так и индекса плоидности опухолевых клеток (6, 7, 8, 143, 144, 23, 89, 62, 63, 222). Для одновременного учета значений индекса плоидности и пролиферативной активности опухолевых клеток рядом авторов было предложено использование классификаций ДНК-гистограмм: Auer G. et al., 1980,1984 (60, 61); Ewers S. et al., 1984,1989 (98, 99); Baildam A. et al., 1987 (65); Kallioniemi O.-P. et al,1988 (144); В.Н.Богатырев, 1991 (8).
В 90-х годах появилось немало сообщений, отрицающих прогностическую значимость ДНК-плоидности опухоли (228, 230, 252, 253, 96, 206) и значимость определения её пролиферативной активности с помощью оценки доли клеток, находящихся в S-фазе (224, 252).
Другие авторы по-прежнему расценивают анеуплоидность опухоли как фактор достоверно ухудшающий прогноз, особенно у больных без поражения регионарных лимфатических узлов (224, 66, 9); а высокий процент клеток опухоли в S-фазе — как достоверный фактор плохого прогноза (96, 206, 254, 230).
Как было показано Ferno M с соавт., 1995 (101), у больных с РП+ опухолями приём тамоксифена снижал частоту рецидива болезни на протяжении 3-х лет примерно вдвое как в группе с высокой долей клеток в S-фазе (с 43% до 19%), так и в группе с низкой долей клеток в S-фазе (с 17% до 9%). В итоге, при сравнении влияния процента клеток, находящихся в S-фазе, на БРВ больных, получавших тамоксифен, различия между группой с высокой долей клеток в S-фазе и группой с низкой долей клеток в S-фазе нивелировались, хотя у больных, не получавших системной терапии различия БРВ были достоверны.
Среди больных, получавших адъювантную химиотерапию по схеме CAF, показатели БРВ и ОВ были лучшими среди больных, имевших высокий процент клеток в S-фазе, по сравнению с больными, имевшими низкий процент клеток в S-фазе (179).
У больных репродуктивного периода, получавших химиотерапию по схеме CMF, улучшение результатов лечения относилось прежде всего к больным, имевшим высокую пролиферативную активность опухолевых клеток (191).
9.2. Материалы и методы
Проточная цитометрия производилась в лаборатории клинической цитологии НИИКО ОНЦ в.н.с. В.Н.Богатыревым. Образец опухолевой ткани, полученный во время операции, доставлялся в лабораторию цитологии в салфетке, увлажнённой 0,9% раствором NaCl. Опухолевую ткань измельчали (резали бритвой) в чашке Петри в небольшом объеме (0,5 мл) профильтрованного через 0,45 мкм миллипоровый фильтр Трис-НСl-буфера (рН — 7,4) или 0,9% раствора NaCl до получения клеточной суспензии. Клеточную суспензию тщательно перемешивали в течение 3 минут автоматической пипеткой до получения однородной взвеси клеток, затем фильтровали в градуированную центрифужную пробирку сначала через редкий фильтр (поры 500 — 600 мкм), затем через стандартный нейлоновый фильтр с диаметром пор 100 — 130 мкм.
Далее суспензия фиксировалась (если нужно было отсрочить проведение исследования) или сразу после окрашивания исследовалась на проточном анализаторе. Фиксацию клеток осуществляли двумя методами: по методу Darzynkiewicz Z. с соавт. (86) к 1 — 1,5 мл клеточной суспензии добавляли по капле 9 мл холодной (4 градуса С) смеси этанол-ацетон (1:1), все время тщательно пипетируя клеточную взвесь во избежание слипания клеток; по другой методике [Steinkamp J. и соавт., 1974 (231)] к 0,5 — 1,0 мл клеточной суспензии добавлялся по капле 96% этанол, при этом суспензия постоянно пипетировалась с помощью автоматической пипетки. Концентрация спирта в суспензии постепенно увеличивалась до 70% . Пробирки плотно закрывались резиновыми пробками или пленкой Parafilm “M” и, после 48-часовой фиксации при 20 градусах С клетки могли быть подвергнуты окраске.
Окрашивание ДНК осуществлялось акридиновым оранжевым по методу Darzynkiewicz Z. с соавт. (86), либо смесью ethidium bromid + mithramycin (Zante J. et al., 255). Цитометрия производилась на проточных цитометрах: 1) фирмы Becton Dickinson (США), 2) 50-Н фирмы Ortho Instruments (США), 3) ICP-11 фирмы Phywe (ФРГ). Ультрафиолетовое излучение возбуждало флуоресценцию окрашенных ядер, которую улавливали фотоумножители анализатора, преобразуя ее в электрические сигналы, на основании которых прибор строил ДНК-гистограмму. В качестве внутреннего стандарта диплоидных клеток использовали донорские лимфоциты и нормальную ткань молочной железы. Индекс плоидности (ИПл) вычислялся как соотношение интенсивности флуоресценции пика G0/G1 опухолевых клеток к интенсивности флуоресценции пика G0/G1 диплоидного стандарта. По соотношениям площадей: пикаG0/G1, S-фазы и фаз G2/M вычислялось процентное распределение опухолевых клеток по фазам клеточного цикла. Сумма долей клеток, находящихся в S-фазе и фазах G2/M, обозначалась как индекс пролиферативной активности (ИПА). Опухолевая принадлежность исследуемого образца ткани контролировалась с помощью цитологического исследования мазков-отпечатков, взятых из разных участков образца.
9.3. Индекс плоидности
ИПл определён у 268 больных РМЖ I — III стадий. Распределение
Таблица 10. Плоидность (ДНК) опухолей и степень распространённости РМЖ по системе TNM.
| TN(M0) |
Диплоидные |
Тетраплоидные ИПл 1,85 — 2,15 |
Анеуплоиные не тетраплоидные ИПл <1,0; 1,10 — 1,84; >2,15 |
Анеуплоидные многоклоновые |
Всего |
| T1N0 |
41% (26) |
3% (2) |
53% (34) |
3% (2) |
100% (64) |
| T2N0 |
34% (15) |
14% (6) |
48% (21) |
5% (2) |
100% (44) |
| T1-2N1 |
25% (17) |
7% (5) |
63% (43) |
4% (3) |
100% (68) |
| T3-4N0-2+ T1-2N2 |
15% (14) |
5% (4) |
63% (58) |
17% (16) |
100% (92) |
| Всего |
27% (72) |
6% (17) |
58% (156) |
9% (23) |
100% (268) |
больных в зависимости от уровня ИПл и степени распространения опухоли по системе TNM представлено в таблице 10. Частота диплоидных опухолей была максимальной при РМЖ T1N0M0, при больших значениях показателя “Т” частота диплоидных опухолей снижается, нарастает частота анеуплоидных опухолей.
Таблица 11. Частота поражения регионарных лимфатических узлов в зависимости от ИПл опухолевых клеток и критерия “Т”.
| Плоидность опухоли | Т1a,b,с | T2 | T3 | T4a,b,c | Всего |
| Диплоидные,ИПл = 1,0 | 30% 11/37 | 32% 7/22 | 2/2 | 82% 9/11 | 40% 29/72 |
| Тетраплоидные, ИПл 1,85 — 2,15 | 1/3 | 40% 4/10 | 2/3 | 1/1 | 47% 8/17 |
| Анеуплоидные не тетраплоидные, ИПл <1,0; 1,10 — 1,84; >2,15 | 42% 25/59 | 56% 27/48 | 88% 15/17 | 94% 30/32 | 62% 97/156 |
| Многоклоновые анеуплоидные | 1/3 | 4/6 | 3/3 | 91% 10 /11 | 78% 18/23 |
| Всего | 37% 38/102 | 49% 42/ 86 | 88% 22/25 | 91% 50/55 | 57% 152/268 |
С другой стороны, для анеуплоидных опухолей характерна гораздо большая частота метастатического поражения регионарных лимфатических узлов (смотри таблицу 11) и, в частности, — поражения лимфатических узлов с образованием конгломератов (смотри таблицу 12). У больных, имевших анеуплоидные не тетраплоидные опухоли, частота поражения лимфатических узлов была в 1,5 раза выше (р<0,05), а у больных с многоклоновыми опухолями — в 2,0 раза выше (р<0,05) по сравнению с больными, имевшими диплоидные опухоли. Образование конгломератов из поражённых подмышечных лимфатических узлов наблюдалось в 3 раза чаще у больных с многоклоновыми опухолями (р<0,05) и в 2,2 раза чаще у больных с анеуплоидными не тетраплоидными опухолями (р<0,05) по сравнению с больными, имевшими диплоидные опухоли. Частота метастатического поражения лимфатических узлов, в том числе и с формированием конгломератов, у больных с тетраплоидными опухолями была близка к таковой, наблюдавшейся у больных с диплоидными опухолями.
Из 51 больной, имевшей конгломераты из метастатически пораженных регионарных лимфатических узлов (N2), только 7 имели диплоидные опухоли, что составляет 14%. Среди 55 больных, имевших Т4, только 11 больных имели диплоидные опухоли (20%).
Таблица 12. Частота формирования конгломератов из метастатически пораженных регионарных лимфатических узлов (N2) в зависимости от ИПл опухолевых клеток и критерия “Т”.
| Плоидность опухоли |
Т1a,b,c |
Т2 |
Т3 |
Т4a,b,c |
Всего |
| Диплоидные,ИПл = 1,0 |
3% 1/37 |
0% 0/22 |
0/2 |
55% 6/11 |
10% 7/72 |
| Тетраплоидные, ИПл 1,85 — 2,15 |
0/3 |
0% 0/10 |
1/3 |
1/1 |
12% 2/17 |
| Анеуплоидные не тетраплоидные, ИПл <1,0; 1,10 — 1,84; >2,15 |
2% 1/59 |
17% 8/48 |
29% 5/17 |
66% 21/32 |
22% 35/156 |
| Многоклоновые анеуплоидные |
0/3 |
2/6 |
1/3 |
36% 4/11 |
30% 7/23 |
| Всего |
2% 2/102 |
12% 10/86 |
28% 7/25 |
58% 32/55 |
19% 51/268 |
На основании анализа собственного материала невозможно выделить какие-либо особенности плоидности опухолей в зависимости от морфологических форм рака (смотри таблицу 13), процентное распределение плоидных и анеуплоидных опухолей примерно одинаково при сравнении между собой протокового рака и долькового рака, а число больных с редкими гистологическими формами рака и изученной плоидностью опухоли незначительно для сравнительного анализа.
Таблица 13. Гистологические формы рака и плоидность опухолей. Частотное распределение диплоидных и анеуплоидных опухолей в зависимости от гистологической формы.
| Гистологические формы инфильтративного рака | Диплоидные ИПл = 1,0 | Тетраплоидные, ИПл 1,85 — 2,15 |
Анеуплоиные не тетраплоидные ИПл <1,0; 1,10 — 1,84; >2,15 |
Многоклоновые анеуплоидные |
Всего |
| Протоковый | 58 (26%) | 13 (6%) | 127 (58%) | 21 (10%) | 219 (100%) |
| Дольковый | 5 (22%) | 2 ( 9%) | 15 (65%) | 1 (4%) | 23 (100%) |
| Слизистый | 1 | 0 | 2 | 0 | 3 |
| Медуллярный | 2 | 0 | 2 | 0 | 4 |
| Папиллярный | 3 | 0 | 1 | 0 | 4 |
| Тубулярный | 0 | 1 | 3 | 0 | 4 |
| Педжета | 1 | 0 | 1 | 0 | 2 |
| Без уточнения формы | 2 | 1 | 5 | 1 | 9 |
| Всего | 72 (27%) | 17 (6%) | 156 (58%) | 23 (9%) | 268 (100%) |
Из 219 больных с протоковой формой РМЖ и изученной плоидностью опухоли, у 197 определена и степень злокачественности, анализу связи плоидности опухолевых клеток и степени злокачественности посвящена таблица 14. При раке 3 степени злокачественности диплоидные опухоли наблюдаются только в 14% случаев, что в 2 раза реже, чем при раке 2 степени злокачественности (28%, р<0,05) и в 3 раза реже, чем при раке 1 степени злокачественности (42%, р<0,05). Напротив, многоклоновые анеуплоидные опухоли при раке 1 степени злокачественности наблюдались лишь в 3%, при раке 2 степени злокачественности — в 2,7 раза чаще (8%), а при раке 3 степени злокачественности — в 6 раз чаще (18%) по сравнению с опухолями первой группы (р<0,05). Это свидетельствует о корреляции между степенью злокачественности и плоидностью опухоли.
Таблица 14. Частота вариантов плоидности опухолей в зависимости от степени злокачественности протокового рака.
| Степень
злокачественности |
Диплоидные ДИ = 1,0 |
Тетраплоидные ДИ 1,85 — 2,15 |
Анеуплоиные не тетраплоидные ДИ <1,0; 1,10 — 1,84; >2,15 |
Многоклоновые анеуплоидные |
Всего |
| 1 степень |
42% 14/33 |
6% 2/33 |
48% 16/33 |
3% 1/33 |
100% 33/33 |
| 2 степень |
28% 33/120 |
3% 3/120 |
63% 75/120 |
8% 9/120 |
100% 120/120 |
| 3 степень |
14% 6/44 |
14% 6/44 |
55% 24/44 |
18% 8/44 |
100% 44/44 |
| Всего |
27% 53/197 |
6% 11/197 |
58% 115/197 |
9% 18/197 |
100% 197/197 |
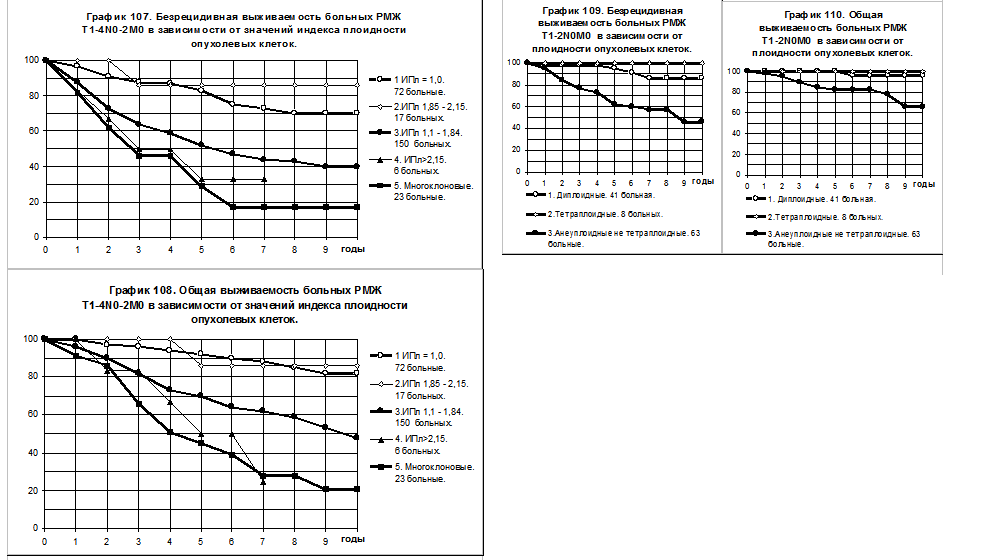
Обобщённая оценка влияния плоидности опухолевых клеток на отдалённые результаты без учёта стадий РМЖ и вида лечения представлена на графиках 107 и 108. Выделены пять групп больных с опухолями, имеющими различные значения ИПл: 1) с диплоидными опухолями, ИПл = 1,0 (72 больные); 2) с тетраплоидными опухолями, ИПл в интервале 1,85 — 2,15 (17 больных); 3) с анеуплоидными опухолями при ИПл в интервале 1,1 — 1,84 и <1,0 (150 больных); 4) с анеуплоидными гипертетраплоидными опухолями, ИПл> 2,15 (6 больных); 5) с многоклоновыми анеуплоидными опухолями, то есть с опухолями, имеющими 2 и более клонов клеток с ИПл не равным 1,0 (23 больные).
У больных 1 и 2 групп отмечалось относительно доброкачественное течение болезни, показатели БРВ и ОВ каждой из этих двух групп статистически значимо отличались от соответствующих показателей каждой из групп 3 — 5 (p<0.005 для показателей больных 1 группы и p<0.05 для показателей больных 2-й группы). Показатели БРВ и ОВ больных с многоклоновыми анеуплоидными опухолями (5 группа) были наихудшими и отличались не только от соответствующих показателей больных 1 и 2 группы, но также и от БРВ и ОВ больных 3 группы (р<0,05). Не наблюдалось статистически значимых различий между группами больных, имевших диплоидные опухоли и имевших тетраплоидные опухоли ни по БРВ, ни по ОВ. Показатели БРВ и ОВ небольшой группы больных с гипертетраплоидными опухолями (4 группа) были промежуточными между показателями группы 3 и 5, различия этих показателей между группами 3 и 4, 4 и 5 были статистически не значимы, при дальнейшем анализе больные с анеуплоидными опухолями при Ипл, находящемся в интервале 1,1 — 1,84, а также <1,0, объединялись с больными, имевшими анеуплоидные гипертетраплоидные опухоли (ИПл> 2,15).
Рассмотрим влияние плоидности и пролиферативной активности опухолевых клеток на течение болезни с учётом степени распространённости рака по системе TNM.
При РМЖ T1-2N0M0 у 41 (37%) больной наблюдались диплоидные и у 71 (63%) больной — анеуплоидные опухоли, в том числе у 8 (7%) больных — тетраплоидные опухоли. Кривые БРВ и ОВ сравниваемых групп представлены на графиках 109 и 110. В группе с тетраплоидными опухолями на протяжении всего времени наблюдений все больные живы без рецидива болезни, однако, из-за малого числа наблюдений, различия БРВ и ОВ с аналогичными показателями обеих других групп статистически не значимы. Течение болезни у больных с диплоидными опухолями так же, относительно доброкачественно, показатели БРВ и ОВ этой группы больных статистически значимо выше, чем больных с анеуплоидными не тетраплоидными опухолями (р=0,000864 для БРВ и р=0,01799 для ОВ). За всё время наблюдений в последней группе больных рецидив болезни наблюдался в 3,2 раза чаще, а смерть — в 2,8 раза чаще, чем у больных с диплоидными опухолями.
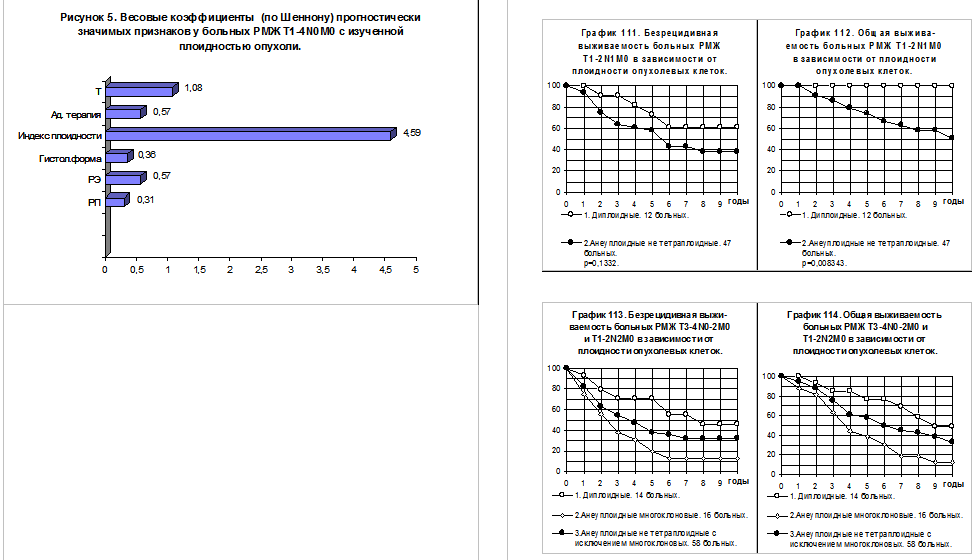
При многофакторном анализе прогностических признаков у больных РМЖ без поражения регионарных лимфатических узлов (рисунок 5) Ипл оказался самым сильным фактором прогноза.
При РМЖ T1-2N1M0 у 12 больных наблюдались диплоидные, у 5 — тетраплоидные и у 47 больных — анеуплоидные не тетраплоидные опухоли. Течение болезни у больных с диплоидными и анеуплоидными не тетраплоидными опухолями отражают графики 111 и 112. У группы пациентов с диплоидными опухолями отмечается тенденция к более высоким показателям БРВ (р=0,1332), преимущества ОВ этой группы больных более выражены и статистически значимы. Из 5 больных с тетраплоидными опухолями у 2 развился рецидив болезни, одна из больных умерла.
При РМЖT3-4N0-2M0 + T1-2N2M0 у 14 больных наблюдались диплоидные, у 4 — тетраплоидные и у 74 больных — анеуплоидные не тетраплоидные опухоли, в том числе у 16 — анеуплоидные многоклоновые. Из 4 больных с тетраплоидными опухолями у 1 больной наблюдался рецидив болезни с летальным исходом.
Анализ БРВ и ОВ представлен на графиках 113 и 114. 1 группу составили больные с диплоидными опухолями, 2 группу — больные с анеуплоидными многоклоновыми опухолями и 3 группу — больные (58) с анеуплоидными не тетраплоидными опухолями с исключением многоклоновых опухолей. Во 2-й группе больных наблюдалось катастрофическое развитие болезни, 5-летняя и 10-летняя БРВ составили 19% и 13% соответственно, 5-летняя и 10-летняя ОВ — 38% и 13%. У больных 1 группы наблюдалось относительно медленное развитие болезни, 2 группа больных занимала промежуточное положение. Различия БРВ и ОВ были статистически значимы при сравнении соответствующих показателей между группами 1 и 3 (для БРВ р=0,01335; для ОВ р=0,01412).
По данным многофакторного анализа прогностических признаков у больных РМЖ с поражением регионарных лимфатических узлов ИПл был одним из средних по значимости факторов прогноза (смотри рисунок 6).
9.4. Показатели интенсивности пролиферации
Из 268 больных с изученной плоидностью опухоли, распределение опухолевых клеток по фазам клеточного цикла определено у 212, частота активно пролиферирующих клеток в зависимости от их плоидности представлена в таблице 15.
По любому из трёх показателей пролиферативной активности видно, что она минимальна у диплоидных опухолей и выше у анеуплоидных опухолей, причём кратность повышения показателя наибольшая для ИПА, если доля опухолей с процентом клеток в S-фазе, превышающим условное пороговое значение, среди анеуплоидных опухолей в 1,6 — 2,4 раза выше, чем среди диплоидных опухолей, то это соотношение по ИПА составляет 2,8 — 3,7 раза (по фазам G2/M — 1,2 — 2,1 раза).
Таблица 15. Частота активно пролиферирующих опухолей в зависимости от ИПл опухолевых клеток и показателя оценки пролиферативной активности.
| Плоидность опухоли |
S>10% |
G2/M >15% |
ИПА>=30% |
| Диплоидные,ИПл = 1,0 |
19% 12/64 |
20% 13/64 |
11% 7/64 |
| Тетраплоидные,ИПл 1,85 — 2,15 |
31% 4/13 |
23% 3/13 |
31% 4/13 |
| Анеуплоидные не тетраплоидные, ИПл <1,0; 1,10 — 1,84; >2,15 |
46% 52/113 |
32% 36/113 |
36% 41/113 |
| Многоклоновые анеуплоидные |
41% 9/22 |
41% 9/22 |
41% 9/22 |
| Всего |
36% 77/212 |
29% 61/212 |
29% 61/212 |
Разделение группы больных с диплоидными опухолями по трём традиционным градациям доли клеток, находящихся в S-фазе, показывает, что эта характеристика пролиферативной активности опухоли имеет влияние на течение болезни (графики 115 и 116). Имеется тенденция к более высоким показателям БРВ больных, имевших долю опухолевых клеток в S-фазе <6%, по сравнению с больными, имевшими долю опухолевых клеток в S-фазе от 6 до 12%; различия показателей ОВ между этими группами больных статистически значимы (р=0,0167). Число больных с диплоидными опухолями, имевшими >12% клеток в S-фазе, невелико, сравнение этой группы с другими группами больных не даёт статистически значимых различий.
Анализу влияния активности пролиферативных процессов в опухолях со всеми видами анеуплоидии на БРВ и ОВ по доле опухолевых клеток, находящихся в S-фазе, посвящены графики 117 и 118. Не прослеживается заметной зависимости БРВ больных от колебаний этого показателя. Только при анализе ОВ можно отметить тенденцию к ухудшению течения болезни у пациентов с опухолями, имевшими >12% клеток в S-фазе.
Возможно, что оценка пролиферативной активности опухоли по доле клеток, находящихся в S-фазе, не является оптимальной, так как S-фаза не охватывает всех клеток, находящихся в делении. Суммарным показателем интенсивности деления клеток является ИПА, вычислявшийся как сумма долей (выраженных в процентах) клеток, находящихся в S-, G2- и M- фазах клеточного цикла. Больные с диплоидными опухолями были разделены на две группы (смотри графики 119 и 120) в зависимости от величины ИПА: 1) с ИПА>= 25% и 2) с ИПА <25%. Имелась слабая тенденция к более низким показателям БРВ на протяжении первых трёх лет у больных первой группы по сравнению с больными второй группы. Такая же, но более выраженная тенденция наблюдалась при анализе кривых ОВ, хотя статистически значимых различий не наблюдалось.
У больных с опухолями, имевшими все виды анеуплоидии, при разделении на группы с ИПА>= 25% и с ИПА <25%, для последней группы больных были характерны более высокие значения БРВ и ОВ по сравнению с первой группой, однако различия между группами не были статистически значимы (графики 121 и 122).
Из 41 больной диплоидным ракомT1-2N0M0 распределение клеток по фазам клеточного цикла изучено у 37, 14 из них с долей клеток в S-фазе менее 6%, 19 — с долей клеток в S-фазе от 6 до 12% и 4 — с долей клеток в S-фазе более 12%. Последняя группа больных недостаточна для статистического анализа, кривые БРВ и ОВ первых двух групп представлены на графиках 123 и 124. В первой группе за всё время наблюдений не произошло ни рецидива болезни, ни смерти, различия показателей БРВ и ОВ в сравнении с группой больных с диплоидными опухолями, имеющими 6-12% клеток в S-фазе статистически значимы.
У 62 больных РМЖ T1-2N0M0 с анеуплоидными не тетраплоидными опухолями так же анализировано процентное содержание клеток в S-фазе. 11 больных имели опухоли с долей клеток в S-фазе <6% (1 группа), 27 — 6-12% (2 группа) и 13 — > 12% (3 группа). Не наблюдалось каких- либо различий между группами по БРВ, однако имелась выраженная тенденция к более низким показателям ОВ больных 3 группы по сравнению с 1 и 2 группами (графики 125 и 126).
При разделении больных РМЖ T1-2N0M0 с диплоидными опухолями по трём градациям величины ИПА получили следующие группы: ИПА<15% — 11 больных, ИПА 15-30% — 21 больная и ИПА>30% — 5 больных. В последней группе больных наблюдалось 2 рецидива болезни с летальным исходом в обоих случаях, группа не подлежит статистическому
анализу из-за малой численности. Между первыми двумя группами больных не наблюдалось статистически значимых различий по показателям БРВ и ОВ (графики 127 и 128).
Больные с анеуплоидными не тетраплоидными опухолями T1-2N0M0 составили следующие группы в зависимости от уровней ИПА: ИПА<15% — 8 больных, ИПА 15-30% — 22 больная и ИПА>30% — 20 больных. Первая группа не анализируется из-за малого количества больных. Вторая и третья группа имели статистически значимые различия по БРВ и по ОВ (смотри графики 129 и 130), в третьей группе больных течение болезни было значительно хуже, чем во второй.
Графики 131 и 132 демонстрируют возможности разделения больных с одновременным учётом плоидности и ИПА опухолевых клеток. Из всей массы больных РМЖ T1-2N0M0 на графиках не представлены из-за малочисленности две группы: а) с тетраплоидными опухолями (8 больных, все живы без рецидива болезни) и b) с диплоидными опухолями, имеющими ИПА >30% (5 больных, из них 2 умерли от возврата болезни).
Остальные 82 больные, у которых изучен и ИПл и ИПА, составили следующие группы: 1) с диплоидными опухолями и ИПА не более 30% (32 больные); 2) с анеуплоидными не тетраплоидными опухолями и ИПА не более 30% (30 больных); 3) с анеуплоидными не тетраплоидными опухолями и ИПА более 30% (20 больных). У больных 1-й группы наблюдается доброкачественное течение болезни, с высокими показателями БРВ и ОВ. У
больных 3-й группы процесс рецидивирования болезни идёт очень бурно, 3-летняя БРВ составляет лишь 61%, 5-летняя — 43%, 10-летняя — 29%; что сказывается и на низких показателях ОВ. Показатели больных 2-й группы занимают промежуточное положение между 1-й и 3-й группами. Достоверность различий показателей БРВ: между 1 и 2 группами — р=0,07344, между 1 и 3 группами — р=0,000095, между 2 и 3 группами — р=0,02002. Достоверность различий показателей ОВ: между 1 и 2 группами — р=0,3722, между 1 и 3 группами — р=0,000902, между 2 и 3 группами — р=0,01598.
За всё время наблюдений развитие рецидива болезни во 2-й группе отмечалось в 2,4 раза чаще, а в 3-й — 5,9 раза чаще, чем в 1-й; частота смерти во 2-й группе наблюдалась 2,2 раза чаще, а в 3-й — в 11 раз чаще, чем в 1-й группе.
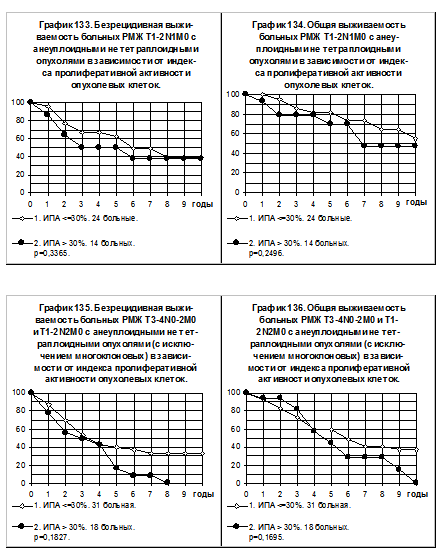
Сравнение БРВ и ОВ больных РМЖ T1-2N1M0 в зависимости от плоидности опухоли и ИПА представлено на графиках 133 и 134. Имеется тенденция к ухудшению течения болезни по показателям БРВ и ОВ в группе больных с анеуплоидными не тетраплоидными опухолями и высокой пролиферативной активностью по сравнению с больными с анеуплоидными не тетраплоидными опухолями и низкой пролиферативной активностью.
При разделении больных РМЖT3-4N0-2M0 + T1-2N2M0 с анеуплоидными не тетраплоидными опухолями с исключением многоклоновых опухолей на больных с интенсивно пролиферирующими опухолями (ИПА>30%, 1 группа, 18 больных) и на больных с неинтенсивно пролиферирующими опухолями (ИПА<=30%, 2 группа, 31 больная) оказалось, что в 1-й группе процесс рецидивирования опухоли идёт значительно быстрее, чем во 2-й группе (смотри графики 135 и 136) . Так 5-летняя БРВ больных 1-й группы составила 16%, а больных 2-й группы — 40%, однако различия статистически не значимы (р=0,1827). Различия ОВ также были очевидны, но не значимы статистически.
9.5. Показатели плоидности и интенсивности пролиферации как факторы, предсказывающие эффективность адъювантной терапии.
Влияние плоидности опухолевых клеток на эффективность адъювантной системной терапии оценивалась у больных РМЖ T1-4N1-2M0 + T3-4N0M0 путём сравнения показателей БРВ и ОВ между группой больных, не получавших адъювантной терапии, с одной стороны, и группой больных, получавших какой-либо вид адъювантной терапии, — с другой стороны (из-за незначительного числа больных, имевших диплоидные и тетраплоидные опухоли, этот анализ проведён только у больных с анеуплоидными не тетраплоидными опухолями).
На графиках 137 и 138 представлены кривые БРВ и ОВ больных РМЖ T1-4N1-2M0 + T3-4N0M0 с анеуплоидными не тетраплоидными опухолями в группах с тремя вариантами адъювантной терапии: 1) отсутствие адъювантной системной терапии — 15 больных, 2) монохимиотерапия тиофосфамидом или химиотерапия по схеме CMF, или комбинированная химиотерапия, включающая доксорубицин с интенсивностью дозы не менее 50% от расчётной (эндокринная терапия не применялась) — 19 больных; 3) только эндокринная терапия тамоксифеном по 20 мг в сутки в течение 2 лет (у больных репродуктивного периода лечению тамоксифеном предшествовало удаление яичников или лучевое подавление их функции) — 11 больных.
У больных второй группы отмечались тенденции к повышению по сравнению с больными первой группы показателей БРВ (р=0,05906) и ОВ (р=0,5076). У больных, получавших тамоксифен (3-я группа), наблюдалась тенденция к повышению БРВ, но не ОВ по сравнению с больными первой группы, различия статистически не значимы.
Резюме
Таким образом, индекс плоидности клеток является важнейшей характеристикой опухоли, очень сильно влияющей на прогноз болезни, особенно у больных без поражения лимфатических узлов. Для диплоидных и тетраплоидных опухолей характерны редкое поражение регионарных лимфатических узлов, редкое и медленное развитие метастазов рака, высокие показатели ОВ. Анеуплоидные не тетраплоидные опухоли наблюдаются у основной массы больных, в целом отличаются большей злокачественностью, чем диплоидные опухоли. Среди анеуплоидных не тетраплоидных опухолей наибольшей агрессивностью отличаются опухоли, имеющие несколько клонов анеуплоидных опухолевых клеток. Оценка интенсивности пролиферативных процессов в опухоли по доле клеток, составляющих S-фазу клеточного цикла, или по ИПА позволяет дополнительно дифференцировать быстро протекающую болезнь от медленно протекающей как среди больных с диплоидными опухолями, так и среди больных с анеуплоидными не тетраплоидными опухолями.