ВР — величина радиоактивности,
ОНРОп — относительное накопление радионуклида (32Р) в опухоли,
ОНРОп1 — исходное ОНРОп,
ОНРОп2 — ОНРОп после противоопухолевой терапии,
Наши исследования по внутритканевой бета-радиометрии проводились в хирургическом отделении опухолей молочных желёз (заведующий отделением профессор В.П.Летягин) и хирургическом отделении опухолей женской репродуктивной системы (заведующий д.м.н. К.П.Лактионов) при содействии сотрудников лаборатории радиоизотопной диагностики (руководитель профессор Р.И.Габуния, затем — к.м.н. С.В.Ширяев) Научно-исследовательского института клинической онкологии Онкологического научного центра РАМН, а также научных сотрудников Физикотехнического института им. А.Ф.Иоффе РАН. Выражаю глубокую благодарность за поддержку в работе сотрудникам перечисленных лабораторий и отделений.
11.1. Литературная справка
32Р почти что забыт современной онкологией, поэтому уместно будет привести основные сведения о его применении.
32Р является чистым бета-излучателем. Средняя энергия бета-частиц равна 0,69 Мэв. Период полураспада составляет 14,3 дня, период полувыведения колеблется от 8 до 12 дней. Средний пробег бета-частицы в ткани — 3 мм. 32Р вводится внутривенно или внутрибрюшинно, или принимается через рот в виде раствора двузамещённого фосфата натрия — Na2HPO4.
Распределение 32Р в тканях изучалось в 40-х годах, так, было показано в экспериментах на крысах (11) что в первые 12 часов после введения препарата, наибольшее удельное количество радиоактивности наблюдалось в печени, почках, мышечной ткани. Через 65 часов наибольший уровень радиоактивности наблюдался в мышцах, селезёнке, почках, костях. При исследованиях на мышах с перевивным РМЖ, лимфомой и лимфосаркомой в первые часы после введения 32Р наблюдали наибольший уровень включения радионуклида в печень, почки, тонкий кишечник. Через несколько часов уровень включения 32Р в указанные органы снижался, наибольший уровень радиоактивности устанавливался в опухолях (142). Было установлено также, что ткань кроветворных органов активно захватывает данный радионуклид (49).
В клетке 32Р в виде фосфата включается в процессы гликолиза, идёт на синтез аденозинтрифосфорной кислоты, дезоксирибонуклеиновой кислоты, рибонуклеиновой кислоты, белков, фосфолипидов (70, 227).
ВР 32Р, применявшаяся различными авторами для диагностических исследований широко варьирует. Можно отметить общую тенденцию к её снижению до 37 — 74 кБк/кг (52, 2, 28, 34, 35, 36, 39). Имеются сведения и о применении более высоких величин: около 250 кБк/кг — (165), 370 кБк/кг — (123), 370 — 888 кБк/кг (211). Для сравнения: ВР 32Р, применяющиеся в лечебных целях при истинной полицитемии, раке яичников, диссеминированном РМЖ, составляют 4 — 5 МБк/кг (146, 192, 248), то есть на 1 — 2 порядка больше, чем при диагностических исследованиях.
Cроки проведения бета-радиометрии после введения 32Р рассматривались во многих работах, наиболее подходящим сроком исследования признаётся 48 часов (1, 2, 29 и др.).
Применение 32Р для нужд диагностики опухолей столкнулось с его несоответствием критериям, предъявляемым (19) к радиофармакологическим препаратам: низкая радиотоксичность — 32Р радиотоксичен, по оценке R.P.Spenser (227) при введении 1 мКи (37 МБк) препарата пациент получает около 15 рад общего облучения всего тела; относительно короткий период полураспада- у 32Р период полураспада относительно велик, — 14,3 суток; удобное для регистрации гамма-излучение — 32Р — «чистый» бета-излучатель, очень существенны проблемы, связанные с бета-радиометрией; необходимые биологические свойства — 32Р не туморотропен, включается во все органы и ткани, особенно — в печень, костный мозг, эпителий кишечника.
У больных, получавших терапевтические величины активности 32Р, наблюдались осложнения, связанные с миэлотоксичностью, -лейкопения, тромбоцитопения, анемия (146, 248, 211, 192). Введение 32Р в слюнные железы в виде коллоидного фосфата хрома крысам Wistar у 64% животных приводило к развитию сарком, карцином и карцино-сарком в месте инъекции в срок до 7 месяцев; таким образом показана канцерогенность 32Р (97).
Предпосылки использования уровня включения 32Р в опухоль для прогнозирования течения болезни можно найти уже в пионерской работе Low-Beer B.V.A. с соавторами, 1946 (165), отметивших, что, в отличие от большинства РМЖ, медленно растущая опухоль накапливает такое же количество радионуклида, как и нормальная ткань. Позже в экспериментах на мышах была обнаружена прямая корреляция между уровнем включения 32Р в опухоли и скоростью их роста (56).
В наблюдениях В.З.Агранат на клиническом материале была продемонстрирована прямая зависимость интенсивности захвата 32Р опухолями околоушной слюнной железы от скорости их роста (1). Возможность прогнозирования течения РМЖ с помощью измерения относительного накопления 32Р в первичной опухоли была показана нами в ряде работ (37, 38, 16, 202, 204, 205, 42).
Непосредственная оценка скорости роста опухоли молочной железы у больных может быть основана на маммографических исследованиях, производимых через значительные интервалы времени. Определение исходного и конечного объёмов опухоли даёт возможность вычислить время её удвоения (113). Период удвоения объёма опухоли остаётся важной биологической характеристикой для остающихся после радикальной операции микрометастазов, от темпа их роста зависит время появления выявляемых метастазов и показатели выживаемости больных (154, 30, 31). Реализация метода требует больших затрат времени и может проводиться только у больных, проходящих маммографический скрининг.
Косвенная оценка скорости роста опухоли основана на изучении интенсивности пролиферации опухолевых клеток путём: вычисления процента клеток, находящихся в митозе, то есть митотического индекса (62); определения доли клеток, находящихся вне фазы покоя, в частности — в S фазе, с помощью проточной цитометрии (79, смотри также главу 9); определения интенсивности включения 3Н-тимидина в ДНК опухолевых клеток in vitro (индекс метки, 134, 176, 177, 223, 224, 225).
На протяжении 90-х годов значительный интерес привлечён к изучению возможности повышения достоверности оценки эффективности противоопухолевого консервативного лечения и, в частности, — оценки эффективности неоадъювантной химиотерапии. Проведение консервативного лечения первичного рака молочной железы лучевыми, химиотерапевтическими, эндокринными воздействиями сталкивается с проблемой оценки эффективности. Это связано с тем, что после проведения эффективного лечения может наблюдаться остаточная опухоль или уплотнение, связанное с фиброзом тканей. Дифференцировка этих состояний нередко сложна и основана на клиническом, ультразвуковом и (или) рентгенологическом обследовании больных в динамике (84, 112, 245).
Общепринятый метод оценки эффективности терапии солидных опухолей по критериям ВОЗ имеет следующие градации: полный эффект — подразумевается исчезновение опухоли на срок не менее, чем 1 месяц; частичный эффект — уменьшение размеров опухоли не менее, чем на 50% на срок не менее, чем 1 месяц; стабилизация — уменьшение размеров опухоли менее, чем на 50% или увеличение размеров менее, чем на 25% на срок не менее, чем 1 месяц; прогрессирование — увеличение размеров опухоли на 25% и больше либо появление новых очагов опухолевого поражения (251).
Недостатком данного метода оценки, является то, что в случаях, леченных с частичным эффектом или со стабилизацией, отсутствует учёт биологической активности остающейся опухолевой ткани в момент контрольного обследования. Метод не позволяет определить (в большинстве случаев) начинающийся рост опухоли, улавливая его лишь при регистрации увеличения размера опухоли на 25% и больше. Понятно, что на это уходит время и, так же понятно, что это время оказывается упущенным для применения других, возможно, эффективных вариантов лечения. С другой стороны, важно иметь полноценную информацию в случаях, когда за опухоль принимается рубец, оставшийся на месте опухоли, для продолжения эффективного лечения или перехода к наблюдению, а не к изменению методов лечения.
Переход от оценки эффективности лечения, основанном только на динамике размеров опухоли, к оценке интенсивности пролиферации её клеток может дать выигрыш во времени. Методы, традиционно применяемые для оценки пролиферативной активности при прогнозировании в узком его понимании (подсчёт митотического индекса при гистологическом исследовании, проточная цитометрия, определение индекса метки), требуют производства биопсии, что, как правило, не удобно для мониторинга пролиферативных процессов опухоли в процессе терапии.
Описаны четыре принципиальных метода, позволяющих проводить такой мониторинг, каждый из них по своей сути является биохимическим исследованием, проводимым в организме пациента. Во-первых, это магнитно-резонансное исследование, включающее, в том числе и оценку синтеза фосфорных соединений в опухоли (186, 150, 85, 55, 240). Во-вторых, это разработанный экспериментально в отделе молекулярно-биологических и радиоизотопных методов исследований (руководитель — проф. А.С.Ягубов) ОНЦ РАМН метод, основанный на регистрации динамики гамма-радиоактивности опухоли, после введения животным дезоксиуридина, меченного изотопами I. В-третьих, это позитрон-эмиссионная томография c применением 18-фтордезоксиглюкозы (247, 78, 249). Наконец, это наш скромный опыт по внутритканевой бета-радиометрии (37, 38, 14, 202), изложенный в настоящей главе.
Широкое применение химиотерапии и лучевой терапии в качестве предоперационного воздействия при местнораспространённом РМЖ делает необходимой точную оценку эффективности лечения ещё и для оценки операбельности.
Правильное определение операбельности позволяет для каждого больного оптимизировать лечение за счёт отказа от операций, сопровождающихся быстрым местнорегионарным возвратом болезни, в пользу модификации и интенсификации консервативного лечения. Как известно, понятие операбельности при РМЖ подразумевает не просто техническую возможность полного удаления опухоли, но возможность достижения с помощью операции стойкого местнорегионарного контроля болезни (127). Исходя из приведённой классической формулировки оценка операбельности и прогнозирование возникновения местных рецидивов и регионарных метастазов после радикальной операции — это одно и то же. Проблема оценки операбельности у больных с местным и/или регионарным распространением РМЖ остаётся актуальной, причём плоидность опухолевых клеток, доля клеток, находящихся в S-фазе, уровень РЭ не имеют дополнительного значения для прогнозирвания местно-регионарного рецидива болезни (100). Как было показано нами, для этих целей перспективно использование относительного накопления 32Р в остаточной опухоли (37, 38, 15, 202, 203).
В настоящее время общепринято оценивать операбельность по клинической или клинико-рентгенологической динамике местных проявлений: уменьшению, увеличению или стабилизации первичной опухоли, отёка кожи и метастазов в регионарных лимфатических узлах (199, 48). В то же время может оказаться полезным для оценки операбельности больных РМЖ III стадии, прошедших предоперационное лечение с частичным эффектом или стабилизацией, определение интенсивности включения 32Р в опухоль.
11.2. Разработка метода внутриопухолевой бета-радиометрии.
Ещё в пионерских работах V.A Low-Beer. с соавторами (165, 166) было показано, что эффективность бета-радиометрии и её количественный результат сильно зависят от расстояния между сцинтилляцинной камерой и поверхностью опухоли, какой-либо счёт радиоактивности опухоли был возможен только в случаях её поверхностного расположения. Эту особенность радиофосфорного исследования отмечали все, кто им занимался, было очевидно, что выраженная зависимость величины ОНРОп от расстояния между опухолью и бета-детектором обусловлена низкой энергией бета-частиц, испускаемых 32Р, и, вследствие этого, — очень малой средней длиной пробега бета-частицы в тканях (3 мм). Так, было показано (123), что уровень ОНРОп, определяемый на операционном препарате, может на порядок превышать таковой, определённый с помощью наружной детекции.
Стандартизация расстояния между поверхностью опухоли при РМЖ и накожным устройством, регистрирующим импульсы, осталась нерешённой проблемой. С другой стороны, понятие “поверхности” опухоли для большинства случаев РМЖ является чистой абстракцией, напомним, что клинической и морфологической характеристикой рака является отсутствие чёткой границы опухоли. Лучи опухолевой ткани, отходящие от опухолевого массива, развиты от случая к случаю чрезвычайно вариабельно, прикладывание регистрирующего устройства к опухоли осуществляется всякий раз с различным расстоянием от устройства до центра опухоли, что приводит к невоспроизводимым результатам бета- радиометрии и затрудняет их клиническую оценку.
Методической особенностью работы по инвазивной бета-радиометрии (32), предшествовавшей нашей, опять-таки, была вариабельность соотношения опухоли и бета-детектора, как пишет А.К.Непесов, «При помощи игольчатого бета-зонда мы могли подойти вплотную к опухоли и даже войти в неё», то есть и бета-радиометрия производилась с расположением бета-детектора либо на “поверхности” опухоли, либо в самой её массе.
ВР вводимого радионуклида и оптимальное время производства исследования после этого введения для РМЖ разработаны только применительно к наружной бета-радиометрии, использующей счётчики Гейгера-Мюллера, возможность уменьшения ВР и изменения сроков исследования при проведении внутритканевой бета-радиометрии, использующей полупроводниковые бета-детекторы, не изучены.
В связи с уникальностью выполнения внутритканевой бета-радиометрии при РМЖ в литературе не разработаны также вопросы, относящиеся собственно к внутритканевому исследованию: сравнение результатов инвазивного исследования с результатами, полученными на операционном материале; характеристика осложнений исследования (например, инфекционных; возможность ускорения развития опухоли в результате её травмы).
Таким образом, перед нами стояли следующие методические задачи: 1) стандартизация пространственного соотношения опухоли и бета-детектора, 2) выбор минимальной ВР, позволяющей производить внутритканевую бета-радиометрию, 3) выбор оптимального временного интервала между введением радионуклида и бета-радиометрией, 4) оценка адекватности внутритканевой бета-радиометрии in vivo в сравнении с бета-радиометрией, осуществляемой на операционном материале, 5) анализ осложнений метода.
Определение ОНРОп осуществлялось с помощью полупроводникового бета-детектора, расположенного в игловидном корпусе диаметром 2 мм, соединённого с предусилителем, усилителем и счётным устройством (3). Оригинальная аппаратура была разработана и представлена нам для испытаний сотрудниками Физико-технического института им. А.Ф.Иоффе РАН.
При внутритканевом расположении бета-детектора абсолютное большинство импульсов регистрируется от тканей, располагающихся на удалении в пределах 3 мм (средняя длина пробега бета-частицы в тканях) от детектора, а вычисление объёма этих тканей сводится к вычислению объёма цилиндра высотой 3,4 мм (длина детектора) и радиусом основания — 3 мм, то есть 96 мм3. В качестве решения проблемы стандартизации пространственного соотношения опухоли и бета-детектора мы избрали внутриопухолевое расположение бета-детектора, а именно — центр опухоли. Таким образом исключаются вопросы, связанные с фиксацией расстояния от устройства, регистрирующего импульсы, до поверхности опухоли и трудности идентификации самой поверхности. Для получения эффективного счёта необходимо добиться облегания бета-детектора опухолевой тканью толщиной не менее 3 мм, что в большинстве случаев достаточно просто сделать, направляя игловидный бета-зонд в центр опухоли.
Определение ОНРОп осуществлялось следующим образом.
1. Больным внутривенно вводился двузамещенный фосфат натрия, меченный Р32 с ВР 37 — 185 кБк/кг (1 — 5 мкКи/кг). Исходной была ВР 185 кБк/кг (5 мкКи/кг), в процессе работы ВР радионуклида была снижена до 37 — 74 кБк/кг (1 — 2 мкКи_/кг).
2. Игольчатым бета-детектором измерялась фоновая радиоактивность трижды по 100 секунд: а1, а2, а3. Вычислялась средняя арифметическая “а” по формуле:
а1 + а2 + а3
а = ————-
3
3. Больной, обнаженной по пояс, в положении лёжа на спине 5% спиртовым раствором йода обрабатывалась кожа молочных желёз. 0,5% раствором новокаина анестезировалась кожа на участке, симметричном опухоли и кожа над опухолью. Иглой диаметром 1,5 — 2,0 мм перфорировалась кожа здоровой молочной железы, игольчатый бета-детектор внедрялся в ткань железы на участке, симметричном опухоли, трижды измерялось число импульсов за интервалы по 100 секунд: b1, b2, b3. Бета-детектор извлекался, вычислялась средняя арифметическая ”b” по формуле:
b1 + b2 + b3
b = —————
3
4. Иглой диаметром 1,5 — 2,0 мм перфорировалась кожа больной молочной железы, бета-детектор внедрялся в центр опухоли, трижды измерялось число импульсов за интервалы по 100 секунд: c1, c2, c3. Бета- детектор извлекался. Кожа в местах пункций обрабатывалась раствором йода. Вычислялась средняя арифметическая “с” по формуле:
с1 + с2 + с3
с = —————.
3
5. Вычислялось ОНРОп в процентах по формуле:
(с — а) х 100
ОНРОп = —————.
b — a
Таблица 38. ОНРОп1 инвазивным методом и превышение фоновой радиоактивности в нормальной ткани молочной железы при варьировании вводимой величины радиоактивности (ВР) 32Р.
|
ВР в кБк/кг |
Число исследованных опухолей |
Кратность превышения радиоактивности нормальной ткани молочной железы над фоновой радиоактивностью. M+/-m Диапазон |
ОНРОп1 в % M+/-m Диапазон |
||
|
37 |
19 |
8,5+/-1,9 |
1,7 — 28 |
1630+/-368 |
124- 6350 |
|
74 |
47 |
10,9+/-1,5 |
1,8 — 42 |
1286+/-200 |
94 — 6367 |
|
185 |
49 |
30,0+/-3,8 |
1,9 — 100 |
1601+/-335 |
111-10565 |
|
Всего |
115 |
18,6+/-2,1 |
1,7 — 100 |
1477+/-174 |
94 — 10565 |
Примечание: различия статистически не значимы.
С целью ориентации в накоплении 32Р нормальной тканью молочной железы в зависимости от ВР радионуклида и сроков исследования после его введения дополнительно вычислялось соотношение b/a, то есть соотношение радиоактивности нормальной ткани к фоновой радиоактивности.
На этапе отработки метода нами исследовано 115 опухолей у 102 больных, в том числе 74 опухоли у 72 больных были исследованы in vivo до начала лечения с вычислением ОНРОп1. В 41 случае определение ОНРОп1 производилось на операционном препарате, что позволяло под контролем глаза устанавливать локализацию бета-детектора, уровень радиоактивности опухоли в этих случаях сравнивался с максимально удалённым от неё участком нормальной ткани молочной железы. У 3 больных с поверхностным поражением (рак Педжета соска, метастатическое поражение кожи, изъязвление опухоли) исследование ОНРОп1 производилось путём наружной бета-радиометрии. При этом уровень относительного накопления 32Р вычислялся относительно радиоактивности кожи симметричного участка здоровой молочной железы.
Средние величины ОНРОп1, определённого инвазивным методом, составили 1477+/-174% (см. табл. 38), ОНРОп1, определённого методом наружной детекции — 198+/-27% (р<0,01).
Мы использовали 32Р с ВР 185, 74 и 37 кБк/кг, как видно из таблицы 38, не наблюдается различий уровня ОНРОп1 от ВР, все использовавшиеся ВР приемлемы для измерения ОНРОп. Каких-либо преимуществ при введении 185 кБк/кг не было получено, что позволило отказаться от этой ВР в пользу меньших.
Таблицы 39 и 40 демонстрируют, что в интервале 2 — 170 часов проведение исследования вполне возможно, однако, начиная с третьих суток после введения радионуклида отмечается тенденция к снижению ОНРОп1. Поэтому мы считаем желательным выполнение бета-радиометрии в первые 50 часов после введения 32Р.
Таблица 39. ОНРОп1 и превышение фоновой радиоактивности в нормальной ткани молочной железы при инвазивном исследовании через разные сроки после введения 37 — 74 кБк/кг 32Р.
|
Сроки в часах |
Число исследованных опухолей |
Кратность превышения радиоактивности нормальной ткани молочной железы над фоновой радиоактивностью. M+/-m Диапазон |
ОНРОп1 в % M+/-m Диапазон |
||
|
2 — 6 |
3 |
12,5+/-5,3 |
6,3 — 23,0 |
2689+/-1542 |
543- 5681 |
|
22 — 26 |
21 |
11,6+/-1,9 |
1,8 — 42,4 |
1365 +/- 203 |
94- 3936 |
|
46 — 50 |
24 |
9,1+/-1,6 |
1,7 — 29,1 |
1645 +/- 341 |
124- 6367 |
|
70 — 74 |
6 |
11,3+/- 1,6 |
4,0 — 27,9 |
624 +/- 232 |
188- 1667 |
|
94 — 98 |
6 |
10,7+/- 3,4 |
4,0 — 26,2 |
1091 +/- 590 |
100- 3800 |
|
118- 170 |
6 |
8,3+/- 2,5 |
2,4 — 20,7 |
818 +/- 218 |
269- 1714 |
Примечание: различия статистически не значимы.
Таблица 40. ОНРОп1 и превышение фоновой радиоактивности в нормальной ткани молочной железы при инвазивном исследовании через разные сроки после введения 185 кБк/кг 32Р.
|
Сроки в часах |
Число исследованных опухолей |
Кратность превышения радиоактивности нормальной ткани молочной железы над фоновой радиоактивностью. M+/-m Диапазон |
ОНРОп1 в % M+/-m Диапазон |
||
|
46 — 50 |
28 |
27,7+/- 4,6 |
3,3- 99,2 |
1666+/-438 |
128 -10565 |
|
70 — 74 |
6 |
30,9+8,1 |
6,5- 62,1 |
2264+/-1480 |
157- 9540 |
Примечание: различия статистически не значимы.
Из таблицы 41 видно, что статистически значимых различий величин ОНРОп1 в зависимости от применяемого варианта внутритканевого исследования не наблюдается, то есть бета-радиометрия, осуществляемая in vivo, правильно отражает истинный уровень радиоактивности тканей. В то же время, нельзя не отметить явную тенденцию к снижению уровня ОНРОп1 при исследовании опухолей <2 см in vivo. По-видимому, это связано с недостаточно точным попаданием чувствительной части бета-зонда в центр столь небольших опухолей.
Таблица 41. ОНРОп1 инвазивным методом в зависимости от варианта внутритканевого исследования и размеров опухоли.
|
Размер опухоли в см |
ОНРОп1 в процентах при вариантах внутритканевого исследования (M+m), в скобках — число исследований in vivo на препарате Всего |
||
|
<= 2,0 |
593 +/- 171 (4) |
1453 +/- 245 (16) |
1281 +/- 213 (20) |
|
2,1 — 5,0 |
1654 +/- 393 (24) |
1054 +/- 287 (20) |
1381 +/- 256 (44) |
|
> 5,0 |
1767 +/- 376 (39) |
1630 +/- 630 (5) |
1751 +/- 352 (44) |
|
Итого |
1656 +/- 270 (67*) |
1280 +/- 184 (41) |
1513 +/- 185 (108) |
Примечание: *- ещё у 7 больных с изученным ОНРОп1 не документирован размер опухоли; различия величин статистически не значимы.
Ни в одном случае применения метода внутритканевой бета-радиометрии не наблюдалось каких-либо осложнений местного или общего характера.
В связи с потенциально возможным провоцированием ускоренного развития опухоли в результате внедрения в неё инородного тела, нами сравнены показатели безрецидивной выживаемости больных раком молочной железы III стадии, которым проводилось внутритканевое исследование, с аналогичными показателями общего массива больных, лечившихся в то же время теми же методами с той же исходной степенью распространенности опухоли. Так, двухлетняя безрецидивная выживаемость всех 244 больных РМЖ T3-4N2M0 составила 64,5+/-3,5%, в том числе больных, которым производилась инвазивная бета-радиометрия (20 больных) — 67,0+/-11,2%; всех 334 больных РМЖ T1-2N2M0 и T3-4N0-1M0 — 85,2+/-2,1%, в том числе больных, которым производилась инвазивная бета-радиометрия (17 больных) — 84,5+/-10,5%. Различий безрецидивной выживаемости в зависимости от применения внутритканевой бета-радиометрии не наблюдается.
Важным преимуществом внутритканевой бета-радиометрии и, в частности, внутриопухолевого расположения бета-детектора, является качественное повышение эффективности счёта. Так, при накожном радиофосфорном исследовании с помощью сцинтилляционного бета-счётчика средние значения ОНРОп при РМЖ составили 161,0 +/- 7,0% (1). В нашем исследовании средние значения ОНРОп1 при внутриопухолевой бета-радиометрии составили 1477+/-174%; при наружной бета-радиометрии — 198+/-27%. Столь высокие различия эффективности счёта легко объяснимы при учёте средней длины пробега бета-частиц, испускаемых 32Р, в тканях (3 мм).
А.К.Непесов (32) не приводит средних величин ОНРОп, судить о них можно только по частотному распределению величин: у всех обследованных 42 больных раком молочной железы наблюдалось относительное накопление 32Р превышающее 135%, у 10 больных (24%) ОНРОп превышало 200%. При нашем методе уровень ОНРОп1, превышающий 200%, был получен в 90% случаев.
Таким образом, внутриопухолевая бета-радиометрия обеспечивает оптимальные пространственные соотношения бета-детектора и опухолевой ткани, что позволяет измерять истинные величины ОНРОп. Метод не провоцирует ускоренное развитие опухоли, его применение возможно без выполнения операции, то есть in vivo, для него не свойственно развитие осложнений местного или общего характера. Выполнение внутриопухолевой бета-радиометрии возможно с использованием 32Р с ВР в диапазоне 37 — 185 кБк/кг во временном интервале от 2 до 170 часов после введения радионуклида.
11.3. Общие закономерности.
У 130 больных РМЖ, до начала противоопухолевого лечения определялось ОНРОп1, у 62 больных РМЖ в разные сроки после консервативного противоопухолевого лечения (лучевого, химиотерапевтического, эндокринного) определено ОНРОп2 внутриопухолевым методом. Средние значения ОНРОп1 составили 1477 +/-174 %, ОНРОп2 — 486+/-81% (разли-чия статистически значимы, Р<0,01).
Можно отметить тенденцию к повышению среднего уровня ОНРОп1 у больных, обследованных в лютеиновую фазу цикла, когда уровень эстрогенов и прогестерона в крови повышен, по сравнению с больными, обследованными в фолликулиновую фазу (смотри таблицу 42). Различий средних величин ОНРОп1 между больными репродуктивного периода с одной стороны и больными, находящимися в менопаузе, с другой — не наблюдалось.
Таблица 42. Уровень ОНРОп1 в зависимости от репродуктивного статуса и фазы овариального цикла.
|
Группы обследуемых |
Число исследований |
ОНРОп1 в %, M +/- m |
|
Больные репродуктивного периода * |
59 |
1469 +/- 291 |
|
в том числе в фолликулиновой фазе** |
18 |
1105 +/- 341 |
|
в том числе в лютеиновой фазе*** |
30 |
1611 +/- 473 |
|
Больные в менопаузе |
52 |
1398 +/- 205 |
Примечание: *- включая больных с нарушениями овариально-менструального цикла, в том числе климактерическими, а также больных, обследованных в 11-13 дни цикла.
** — с 2 по 10 день овариально-менструального цикла,
*** — с 14 по 30 день овариально-менструального цикла.
Различия статистически не значимы.
Больные с обширным метастатическим поражением регионарных лимфатических узлов (N2) имели более высокие средние значения ОНРОп1, чем больные, не имевшие регионарных метастазов (N0) или имевшие метастазы в неспаянных подмышечных лимфатических узлах (N1, смотри таблицу 43).
Таблица 43. ОНРОп1 в процентах (M +/- m) в зависимости от вариантов N (в скобках указано число больных).
-
N0
N1
N2
1252+/-215 (37)
1202+/-185 (41)
2331+/-609* (23)
Примечание:* — статистически значимые различия в сравнении с группами больных, имевших N0 и N1, P<0,05.
У больных с разными морфологическими формами рака не обнаружено закономерных различий уровня ОНРОп1, отмечена тенденция к снижению ОНРОп1 при слизистом раке (смотри таблицу 44). Очевидно, что корреляции уровня ОНРОп1 с одной из двух наиболее частых форм РМЖ — протоковым раком и дольковым раком — не прослеживается. У больных медуллярным и папиллярным раком наблюдались высокие уровни ОНРОп1.
Таблица 44. ОНРОп1 в зависимости от гистологической формы рака.
|
Формы инфильтративного рака |
Число исследованных опухолей |
ОНРОп1 в % M+/-m Диапазон |
|
|
Протоковый |
62 |
1482 +/- 222 |
94 — 9540 |
|
Дольковый |
13 |
1289 +/- 389 |
157 — 4630 |
|
Медуллярный |
2 |
3425 +/- 1758 |
1667 — 5183 |
|
Слизистый |
2 |
467 +/- 163 |
304 — 629 |
|
Тубулярный |
1 |
100 |
|
|
Папиллярный |
1 |
3936 |
|
Примечание: различия статистически не значимы.
Тенденция к более высоким средним значениям ОНРОп1 наблюдалась у больных с рецепторонегативными опухолями как по РЭ, так и по РП (смотри таблицу 45).
Таблица 45. ОНРОп1 в зависимости от уровней РЭ и РП.
|
Уровни РЭ и РП |
Число исследований |
ОНРОп1 в % M+/-m Диапазон |
|
|
РЭ+ |
33 |
1034 +/- 205 |
94 — 6119 |
|
РЭ- |
57 |
1758 +/- 301 |
135 — 10565 |
|
РП+ |
36 |
1272 +/- 235 |
94 — 6119 |
|
РП- |
47 |
1852 + 349 |
135 — 10565 |
|
РЭ+ РП+ |
18 |
1082 + 335 |
94 — 6119 |
|
РЭ-РП+ и РЭ+РП- |
30 |
1327 + 215 |
188 — 4630 |
|
РЭ- РП- |
35 |
2110 +/- 455 |
135 — 10565 |
Примечание: различия статистически не значимы.
Таблица 46 демонстрирует присутствие двух видов эндокринных воздействий, по-видимому, оказывающих некоторое влияние на величину ОНРОп1: наличия или отсутствия РЭ и РП в опухоли и фазы овариально-
Таблица 46. ОНРОп1 в зависимости от уровней РЭ, РП и фазы овариально-менструального цикла.
|
Уровни РЭ или РП |
Фаза овариально-менструального цикла |
Число ис-следований |
ОНРОп1 в %, M +/- m |
|
РЭ+ |
фолликулиновая |
4 |
501 +/- 137 |
|
РЭ+ |
лютеиновая |
7 |
625 +/- 267 |
|
РЭ- |
фолликулиновая |
9 |
1383 +/- 587 |
|
РЭ- |
лютеиновая |
20 |
2194 +/- 686 |
|
РП+ |
фолликулиновая |
7 |
674 +/- 201 |
|
РП+ |
лютеиновая |
13 |
1225 +/- 408 |
|
РП- |
фолликулиновая |
6 |
1622 +/- 867 |
|
РП- |
лютеиновая |
12 |
2521 +/- 1073 |
Примечание: фолликулиновая фаза — с 2 по 10 день овариально-менструального цикла, лютеиновая фаза — с 14 по 30 день овариально-менструального цикла. Различия статистически не значимы.
менструального цикла. Интересно отметить, что в лютеиновой фазе, когда уровень эстрогенов и прогестерона в крови повышается, более высокие средние величины ОНРОп1 наблюдаются как в рецепторопозитивных, так и в рецепторонегативных опухолях.
11.4. ОНРОп1 как фактор прогноза
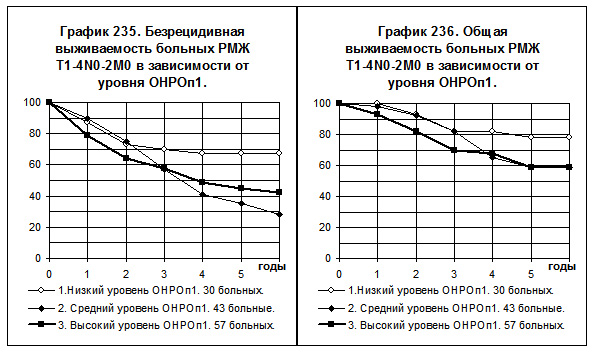
ОНРОп1 изучено у 130 больных РМЖ I — III cтадий. В зависимости от уровня ОНРОп1 все больные были разделены на группы с низким, средним и высоким уровнями ОНРОп1, кривые БРВ и ОВ представлены на графиках 235 и 236. Сроки прослеженности больных
позволяют оценивать 6-летние результаты лечения. Показатели БРВ и ОВ больных с низкими уровнями ОНРОп1 значительно отличаются от соответствующих показателей больных со средним уровнем ОНРОп1 (р=0,02743 для БРВ и р=0,05238 для ОВ) и больных с высоким уровнем ОНРОп1 (р=0,06966 для БРВ и р=0,1376 для ОВ), в двух последних группах показатели БРВ и ОВ близки, что послужило причиной их объединения.
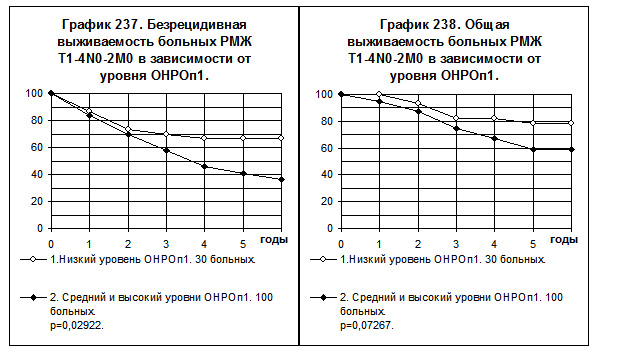
Графики 237 и 238 демонстрируют сравнение отдалённых результатов лечения больных с низким уровнем ОНРОп1 с одной стороны и больных со средним и высоким уровнями ОНРОп1 с другой. В первой группе больных показатели БРВ достоверно выше, чем во второй (р=0,02922), различие показателей ОВ так же очевидно, однако оно статистически не значимо (р=0,07267). Частота рецидива болезни за весь период наблюдений в первой группе больных наблюдалось в 1,6 раза реже, а частота смерти — в 1,7 раза реже, по сравнению с частотой этих событий во второй группе.
При изолированном анализе влияния уровня ОНРОп1 на течение болезни в рамках различной степени распространённости опухоли получены следующие результаты.
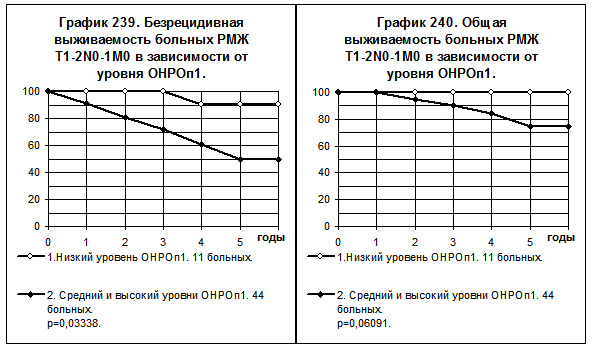
У больных РМЖ T1-2N0-1M0 с низким уровнем ОНРОп1 показатели БРВ и ОВ значительно превышают таковые больных со средним и высоким уровнями ОНРОп1 (смотри графики 239 и 240). Различия БРВ наиболее значительны и статистически значимы (р=0,03338), различия ОВ имеют ха-
рактер тенденции (р=0,06091). Частота рецидива болезни у первых была в 4,7 раза ниже, чем у вторых.
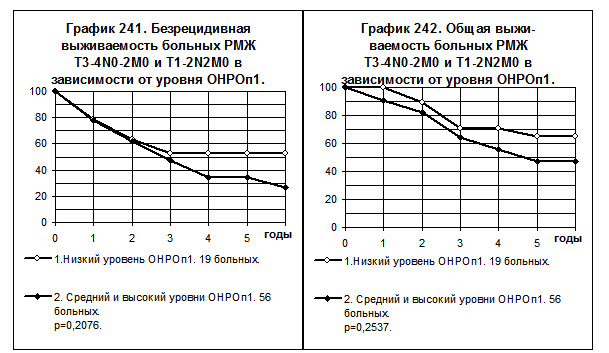
При РМЖ T1-2N2M0 + T3-4N0-2M0 с низким уровнем ОНРОп1 так же наблюдались более высокие значения как БРВ, так и ОВ по сравнению с больными, имевшими средний и высокий уровни ОНРОп1, однако различия статистически не значимы (смотри графики 241 и 242). Медиана безрецидивной выживаемости у первых составила 71 месяц, у вторых — 31 месяц; медиана длительности жизни — 93 месяца и 52 месяца соответственно; частота рецидива за всё время наблюдений у первых была в 1,3 раза ниже, а частота смерти — в 1,4 раза ниже, чем у вторых.
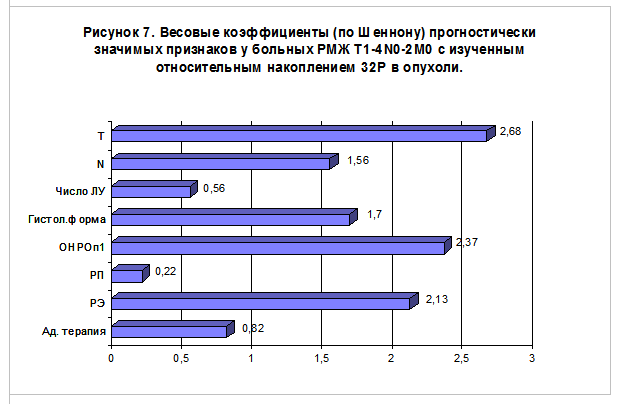
При многофакторном анализе влияние уровня ОНРОп1 на прогноз также оказывается весьма значительным, уступая только критерию “Т” и обходя такие признаки, как гистологическая форма, критерий “N”, число поражённых лимфатических узлов и уровни РЭ и РП. К сожалению, невозможно непосредственно сравнить значимость ОНРОп1 с характеристиками интенсивности пролиферативной активности опухоли, получаемыми при проточной цитометрии, так как одновременно проточная цитометрия и определение ОНРОп1 были произведены только нескольким больным.
11.5. Относительное накопление 32Р в остаточной опухоли.
“Метод полезен в качестве предоперационной
подсказки хирургу, но, может быть, ещё
более полезен в оценке эффекта различных
видов терапии…”
V.A. Low-Beer & R.B. Green, 1952 (166)
Средние величины ОНРОп2, определённого у всех 62 больных после лечения составили 486+/-81%, что значительно ниже средних величин ОНРОп1, — 1477 +/-174% (различия статистически значимы, Р<0,01).
11.5.1. Оценка эффективности противоопухолевой терапии.
Задача данного анализа состоит в том, чтобы оценить полезность измерения ОНРОп2 у больных, леченных со стабилизацией или частичным эффектом.
Анализируются 33 больные РМЖ I — III стадий. Больные получали консервативное лечение (лучевое, химиотерапевтическое, эндокринное, комплексное) в различных вариантах в качестве предоперационного или самостоятельного лечения. У всех больных был достигнут эффект, который первоначально оценивался как частичный или стабилизация. Этим больным производилось определение ОНРОп2, затем больные были прослежены 1-6 месяцев и по результатам течения болезни за этот интервал времени была произведена повторная оценка эффекта по критериям ВОЗ. В группу больных, леченных с полным эффектом, дополнительно были включены прооперированные после определения ОНРОп2 пациенты, у которых полный эффект был установлен по данным гистологического исследования.
Таблица 47. Уровень ОНРОп2 и последующий эффект противоопухолевой терапии.
|
Группы больных |
Число больных |
ОНРОп2 в %, M +/- m |
|
1. С полным эффектом |
16 |
103 +/- 13 |
|
2. С частичным эффектом |
9 |
269 +/- 36 |
|
3. Со стабилизацией |
4 |
580 +/- 260 |
|
4. С прогрессированием |
4 |
3138 +/- 843 |
Примечание: различия не значимы при сравнении 2 группы с 3 группой, при сравнении всех других групп между собой различия статистически значимы, Р<0,01.
Уровень ОНРОп2 в анализируемых группах больных (смотри таблицу 47) хорошо коррелировал с наступившим в последующем эффектом: у больных с низким ОНРОп2 (с уровнем включения 32Р в опухоль практически равным уровню включения 32Р в нормальную ткань) в последующем наступил полный эффект, а у больных с высоким уровнем ОНРОп2, превышающим накопление радионуклида в нормальной ткани в среднем в 30 раз, наблюдалось прогрессирование опухоли. Наряду с этим при средних величинах ОНРОп2 наблюдались истинные состояния стабилизации и частичного эффекта.
Высокий уровень ОНРОп2 не наблюдался у больных 1 — 3 групп, низкий уровень ОНРОп2 наблюдался у 2 больных 2 группы (у одной из них полный эффект наступил через 1 месяц после определения ОНРОп2, у второй — через 3 месяца после определения ОНРОп2) и у 1 больной 3 группы (остаточное уплотнение в молочной железе продолжает оставаться стабильным более 6 месяцев).
Рассмотрим примеры.
Больная М.Н.Ю., 34 лет, история болезни N 88/3453. Диагноз: рак правой молочной железы T4N2M0. Диагноз подтверждён при цитологическом исследовании пунктата из опухоли и по данным гистологического исследования биопсийного материала. Было проведено химиолучевое лечение, включавшее облучение молочной железы в СОД 68 Гр и химиотерапию по схеме CMF. Лечение сопровождалось уменьшением опухоли в размерах. В конце курса лечения проведено определение ОНРОп2 = 114%. Через 1 месяц была произведена радикальная мастэктомия с сохранением большой грудной мышцы. При гистологическом исследовании обнаружен выраженный патоморфоз, элементов опухоли в молочной железе не найдено.
Больная В.Е.Н., 64 лет, история болезни N85/14575. Диагноз: рак правой молочной железы T4N2M0. В январе — марте 1986г. больной было проведено консервативное лечение, включавшее лучевую терапию по радикальной программе и эндокринную терапию тамоксифеном. Достигнут частичный эффект, продолжен приём тамоксифена. 3.06.87 определено ОНРОп2 = 4383%. Диагностировано завершение эффекта лечения, проводилась химиотерапия циклофосфаном, адриамицином, метотрексатом. Однако химиотерапия была неэффективной, через 2 месяца констатировано увеличение первичной опухоли в два раза, ещё через 4 месяца выявлены метастазы в лёгких.
11.5.2. Оценка операбельности рака молочной железы III стадии
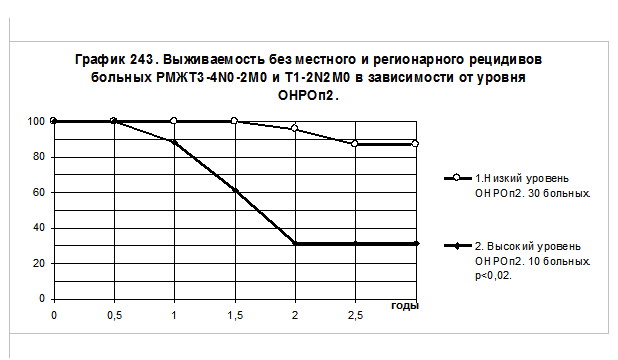
ОНРОп2 после проведения предоперационной терапии определено у 40 больных РМЖ III стадии. Все больные имели частичный эффект или стабилизацию, были прооперированы и получали адъювантную системную терапию. В последующем больные прослежены, процесс развития местно-регионарного рецидива оценён с помощью построения кривых выживаемости без местно-регионарного рецидива актуариальным методом в группах больных с разным уровнем ОНРОп2 (смотри график 243). Статистическая значимость различий определена с помощью подсчёта критерия Х2 (Mantel N., HaenszenW.).
Очевидно, что у больных с относительно высоким уровнем ОНРОп2 вероятность быстрого развития местнорегионарного рецидива значительно выше, чем у больных с низким уровнем ОНРОп2, различия достоверны, P<0,02.
Примеры:
1. Больная К.М.И., история болезни 84/15458. Диагноз: РМЖ T4N2M0. В качестве предоперационного лечения был проведён курс комбинированной химиотерапии, получен частичный эффект. Определен уровень ОНРОп2 = 143%. Произведена радикальная мастэктомия с сохранением большой грудной мышцы. При гистологическом исследовании отмечено наличие умеренного патоморфоза в опухоли. Проводилась профилактическая химиотерапия. Отмечено безрецидивное течение в сроки более 2,5 лет.
2. Больная Т.Н.К., история болезни N 89/5572. Диагноз: РМЖ T4N1M0. Перед операцией была проведена лучевая терапия на молочную железу и зоны регионарного метастазирования в СОД 40 Гр. Лечение с частичным эффектом. Определён уровень ОНРОп2 = 933%. Произведена радикальная мастэктомия с сохранением большой грудной мышцы. В дальнейшем проводилась профилактическая комбинированная химиотерапия. Через 1 год и 3 месяца наступил рецидив болезни с поражением кожи в зоне оперативного вмешательства, регионарных лимфатических узлов, лёгких и печени.
Резюме
32Р в виде фосфата интенсивно включается в синтетические процессы в клетке, в том числе и в синтез нуклеиновых кислот, поэтому относительное накопление 32Р в опухоли отражает интенсивность пролиферативных процессов в ней.
Нами разработан метод внутриопухолевой бета-радиометрии, он безопасен и даёт возможность измерять истинные величины ОНРОп.
Определение ОНРОп1 позволяет выделить медленно рецидивирующие опухоли, что наиболее демонстративно при РМЖ T1-2N0-1M0.
Уровень ОНРОп2 может быть использован как дополнительный фактор оценки эффективности лечения у больных, леченных с частичным эффектом и со стабилизацией, высокий уровень ОНРОп2 означает наличие быстрорастущей опухоли и неэффективность лечения; при низком уровне ОНРОп2 можно говорить об отсутствии элементов опухоли в остаточном уплотнении либо об отсутствии пролиферации клеток остаточной опухоли что может подтверждать наличие эффекта (при соблюдении всех остальных позиций, характеризующих эффект).
У больных РМЖ III стадии, леченных с эффектом или со стабилизацией после предоперационного противоопухолевого лечения, низкий уровень ОНРОп2 позволяет констатировать операбельное состояние. Высокий уровень ОНРОп2 в остаточной опухоли позволяет выделить группу больных с высокой вероятностью быстрого развития местнорегионарного рецидива, то есть больных в неоперабельном состоянии.