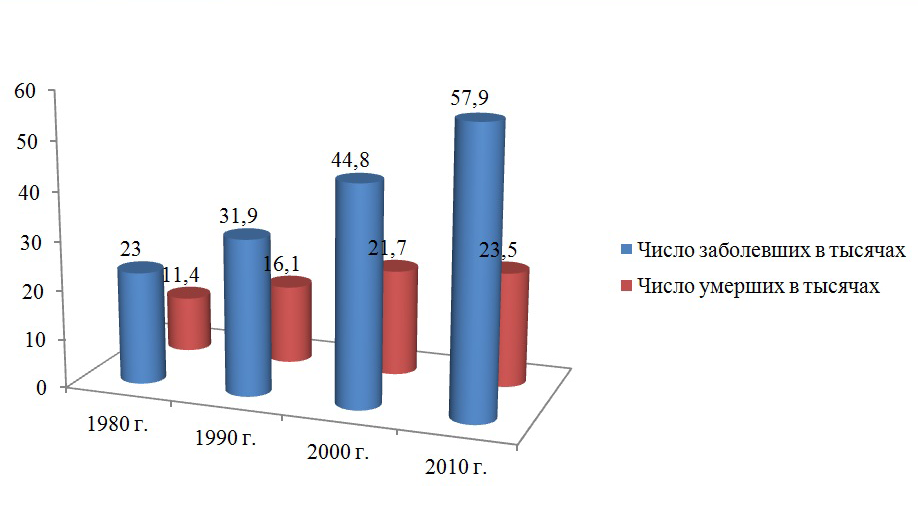
По данным Е.М.Аксель (2013) в России раком молочной железы в 2010 г. заболело 57,9 тыс. человек. За период с 1980 по 2010 гг. абсолютное число заболевших увеличилось в 2,5 раза
Стандартизованные показатели заболеваемости раком молочной железы в развитых странах мира (66,4 на 100 тыс.) в 2,5 раза превышают показатели для развивающихся стран (27,3 на 100 тыс.); аналогичные соотношения характерны и для смертности от рака молочной железы (27,3 и 10,8 на 100 тыс.). В Европе показатели колебались от 59 о/оооо (в Словакии) до 85-90 о/оооо (во Франции, Италии, Ирландии).
Рисунок 1. Динамика абсолютного числа заболевших раком молочной железы и умерших от этой болезни в России (Е.М.Аксель, 2013)
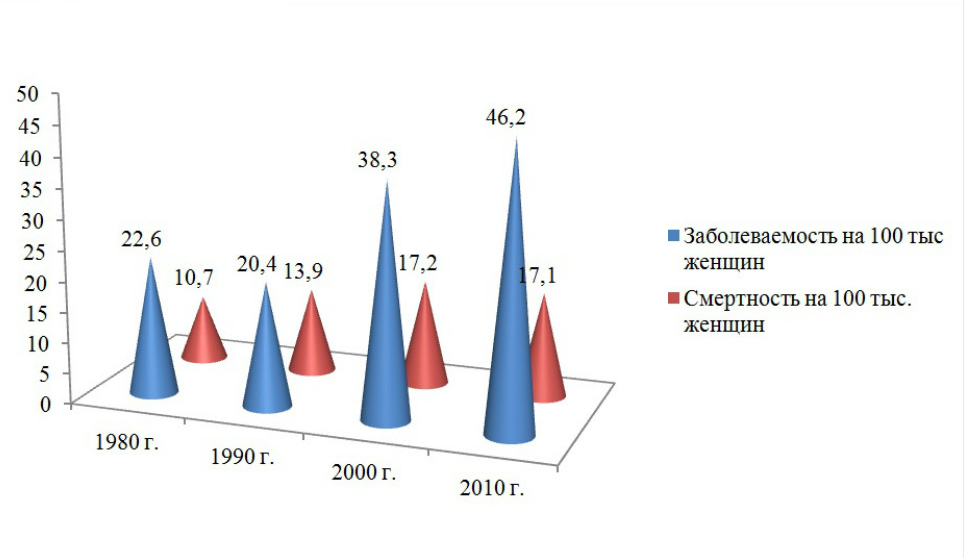
Среди регионов России стандартизованные показатели заболеваемости колебались от 25-30 на 100 тыс. женского населения (республики Дагестан, Тыва, Алтай и Якутия) до 53-77 на 100 тыс. (в Республике Чечня, Чукотском автономном округе, Томской, Камчатской и Омской областях, г. Москва). В 2010 г. заболеваемость РМЖ в целом по России достигла 46,2 на 100 тыс. (рис. 2).
Рисунок 2. Стандартизованные показатели (мировой стандарт) заболеваемости раком молочной железы и смертности от этой болезни в России (Е.М.Аксель, 2013).
В 2010 г. от рака молочной железы умерло 23,5 тыс. больных. В динамике с 1980 г. зарегистрирован рост стандартизованных показателей смертности от РМЖ в России с 10,7 до 17,1 на 100 тыс.; за период 2000-2010 гг. отмечена их стабилизация на уровне 17,1-17,5 на 100 тыс.
Факторы риска, наследование, профилактика
Примерно у 10% больных раком молочной железы развитие болезни обусловлено отягощенной наследственностью. У остальных женщин основными факторами, повышающими вероятность заболеть, являются особенности функционирования их репродуктивной системы: ранний возраст начала менструаций, поздние первые роды или их отсутствие, непродолжительная лактация, длительный прием гормональных контрацептивов, поздняя менопауза, длительная заместительная гормонотерапия в постменопаузе (смотри также таблицу).
Повышение риска развития рака молочной железы (по L.A.Brinton & S.S.Devesa, 1996)
|
Фактор |
Риск |
Фактор |
Риск |
|
Пожилой возраст (> 65 в сравнении с 30-34) |
17 |
Мать или сестра больны раком молочной железы |
2-3 |
|
Место жительства (Европа или Северная Америка против Азии) |
4–5 |
Поздние роды |
2–3 |
|
Место жительства (город в сравнении с деревней) |
1,5 |
Пролиферативаная мастопатия |
2-4 |
|
Высокий рост (>173 см) |
1,5-2 |
Ожирение |
2 |
|
Раннее менархе (<12 лет) |
1,5 |
Поздняя менопауза (>55) |
2 |
Генетически обусловленный рак молочных желез чаще всего наблюдается в виде синдрома наследственного рака молочной железы (среди родственников встречается только рак молочной железы), синдрома наследственного рака молочной железы и рака яичников (у родственников наблюдаются эти две болезни), синдрома Линча 2 (среди родственников – рак молочной железы, раки женской репродуктивной системы и раки желудочно-кишечного тракта). С 1990 года было идентифицировано 4 гена предрасположенности, играющих определенную роль при возникновении рака молочной железы: р53, BRCA (BReast Cancer Associated) 1 и 2, PTEN (Phosphates TENsin). Мутации BRCA1 и BRCA2 ответственны за 30–70% наследственного рака молочной железы. Вероятность развития рака молочной железы и рака яичников у женщин-носительниц мутаций генов BRCA1 или BRCA2 на протяжении жизни чрезвычайно высока (смотри таблицу).
Риск развития рака молочной железы и рака яичников по данным Breast Cancer Linkage Consortium (1999).
|
Патология |
У носителей мутаций |
В общей популяции |
|
|
BRCA 1
|
BRCA 2 |
||
|
Рак молочной железы |
80-85% |
80-95% |
2% |
|
Рак яичников |
60% |
27% |
1% |
|
Рак противоположной молочной железы (у больных односторонним раком молочной железы) |
64%
|
56%
|
4,8%
|
|
Рак яичников (у больных раком молочной железы) |
18% |
8% |
1,8% |
Защитный эффект родов
У женщин, имевших поздние первые роды (в возрасте более 30-ти лет) или не имевших родов, риск заболеть раком молочной железы в 2-3 раза выше, чем у рожавших до 20-ти лет. Каждые последующие роды в возрасте до 30-ти лет сопровождаются дальнейшим снижением риска. Риск заболеть раком молочной железы в возрасте до 40-ка лет в 5,3 раза выше у женщин, рожавших в возрасте >30-ти лет, чем у рожавших до 20-ти лет. Ранние роды не оказывают защитного действия у женщин, имеющих мутации BRCA1 или BRCA2. Рожавшие женщины-носительницы мутаций BRCA1 или BRCA2 существенно чаще (в 1,71 раза) заболевают раком молочной железы в возрасте до 40-ка лет, чем не рожавшие. Каждая беременность у них ассоциируется с возрастанием риска заболеть раком молочной железы в возрасте до 40-ка лет.
Профилактика рака молочной железы с помощью 5-летнего приёма тамоксифена
Исследование, проведенное в США (NSABBP P-1) включало 13 388 женщин, разделенных на 2 группы, принимавших тамоксифен или плацебо (таблетка, не содержащая лекарств). У женщин, получавших тамоксифен, наблюдалось снижение риска заболеть раком молочной железы в целом на 49%, в том числе на 69% снизилась частота гормонально-зависимых опухолей; частота гормонально-независимых опухолей изменилась статистически незначимо.
Профилактическое удаление яичников у носительниц мутаций BRCA1 или BRCA2 снижает риск развития рака яичников на 96% и снижает риск развития рака молочной железы на 53%.
Профилактическая мастэктомия (удаление молочной железы)
Минимальный риск, при котором может быть рекомендована эта процедура, составляет 25%, хотя некоторые Европейские Центры, использующие данный вид операций, учитывают только носительство мутаций генов BRCA1 или BRCA2, предрасполагающих к развитию рака молочной железы. Требования EUSOMA (Европейского общества мастологов) по контролю качества при выполнении профилактической мастэктомии направлены на исключение необоснованно предлагаемых операций, минимизацию психологической травмы, связанной с ее выполнением, и состоят в следующем. Профилактическая мастэктомия снижает риск развития рака молочной железы на 90%. Пациентка должна быть обследована генетиком, генетический диагноз важно подтвердить ДНК-диагностическими методами. Генетик разъяснит варианты дальнейшей тактики: динамическое наблюдение, приём тамоксифена, профилактическое удаление яичников, профилактическая мастэктомия. Если пациентка выбирает профилактическую мастэктомию, с хирургом-маммологом следует обсудить вариант мастэктомии: подкожная либо кожесохраняющая (то есть с удалением сосково-ареолярного комплекса). Необходима консультация пластического хирурга для выбора варианта реконструкции и сроков ее проведения. В «здоровой» молочной железе, удалённой профилактически, с высокой частотой находят предраковые изменения и преинвазивный рак: протоковую атипическую гиперплазию – 39%, дольковую атипическую гиперплазию – 37%, протоковый рак in situ – 15%, дольковый рак in situ – 25%, инвазивный рак – 1%.
Диагностика
Диагностика рака молочной железы основывается на данных врачебного осмотра, ультразвуковом исследовании, маммографии, цитологическом исследовании материала, полученного из патологической зоны путем прокола тонкой иглой или иглой с сердечником (core-biopsy), гистологическом исследовании образцов опухоли. Доказанным считается диагноз, подтвержденный при цитологическом или гистологическом исследованиях. Кроме того, для стадирования обязательно обследуются органы и ткани, в которых наиболее часто могут быть выявлены метастазы, — печень, легкие, кости.
Ранняя диагностика рака молочной железы. Признанным методом ранней диагностики рака молочной железы в общей популяции женщин старше 50 лет является маммографический скрининг (screening – просеивание), то есть обследование здоровых женщин. Маммография позволяет выявить непальпируемые опухоли малых размеров. У женщин 30-49 лет маммографический скрининг менее эффективен из-за большей плотности ткани молочных желез и, вследствие этого, — меньшей чувствительности исследования. Для женщин этой возрастной группы, в том числе находящихся под риском развития наследственного РМЖ, более эффективен скрининг, основанный на магнитно-резонансном исследовании молочных желез.
Лечение
Предложения по лечению рака молочной железы базируются на результатах обследования. Больным с операбельной опухолью (I-II стадий) лечение обычно начинается с операции. Больным с первично иноперабельной опухолью (III стадии) необходимо проведение на первом этапе химиотерапии или сочетания химиотерапии с лучевой терапией или гормонотерапии. Операция становится возможной при успешном лечении. Больным с диссеминированной опухолью (при наличии метастазов в других органах, IV стадии) предлагается проведение лекарственного лечения или сочетания лекарственного лечения с лучевой терапией, а в некоторых случаях – с операцией.
Рассмотрим основные положения местного и общего лечения не диссеминированного рака. Кратко анализируя эволюцию методов хирургического лечения рака молочной железы на протяжении ХХ века, можно выделить две противоположные тенденции: тенденцию к расширению объема операции и тенденцию к сокращению ее объема. Первая связана со стремлением к повышению радикализма за счет широкого удаления пораженных опухолью тканей и тканей, где такое поражение может быть. Для рака молочной железы характерно распространение по протокам и по лимфатическим сосудам, как в пределах молочной железы, так и за ее пределы в лимфатические узлы. Такое распространение при небольших, казалось бы, ограниченных опухолях, может быть выявлено только при микроскопии удаленной ткани, ни рентгенологически, ни при пальпации оно не выявляется. После лечения, ограниченного только удалением опухоли, закономерно возникали рецидивы рака в молочной железе или в ближайших лимфатических узлах. Именно с этим связано широкое применение операций, при которых полностью удаляется молочная железа и жировая клетчатка, в которой находятся ближайшие лимфатические узлы (радикальные мастэктомии).
Потеря молочной железы после радикального лечения по поводу рака представляет не только физический недостаток, но и является, прежде всего, серьезной психической травмой. Желание удалить опухоль и сохранить молочную железу выразилось в исторически более ранних операциях, так как радикальная мастэктомия была альтернативой таким операциям. Вместе с тем, органосохраняющее лечение, не худшее по результатам, чем радикальная мастэктомия, было разработано сравнительно недавно.
Современное представление о возможности сохранения молочной железы основано на представлении о том, что РМЖ даже 1 стадии к моменту его выявления уже имеет существенную вероятность наличия отдаленных гематогенных микрометастазов и проведение операции самого максимального объема не снижает риска реализации микрометастазов в клинически проявляемые метастазы (B.Fisher). К настоящему времени проведено большое количество рандомизированных исследований, сравнивающих, с одной стороны органосохраняющие операции в сочетании с лучевой терапией и радикальную мастэктомию, с другой стороны. Многолетние наблюдения за тысячами больных показали равноценность выживаемости и, следовательно, — адекватность органосохраняющего лечения. В то же время, органосохраняющие операции не могут применяться при всех формах роста и на всех этапах развития рака молочной железы. Показаниями к этим операциям являются небольшой размер опухоли (не более 3 — 4 см), один очаг опухоли, отсутствие распространения опухоли на кожу. Предположительно существующее микроскопическое распространение опухоли по лимфатическим сосудам и протокам в пределах молочной железы подавляется обязательным последующим облучением.
Органосохраняющие операции у больных раком молочной железы носителей мутаций BRCA1 или BRCA2 имеют значение для лечения существующей на данный момент болезни, они не защищают от развития последующих опухолей. В одном из наблюдений сообщается, что частота вторых раков молочной железы у таких больных составила: в оперированной молочной железе – 49%, в противоположной молочной железе – 42%. Эти результаты резко отличаются от результатов таких операций в общей популяции, где частота местных рецидивов может составлять 5-10%. Выполнение двусторонней мастэктомии у женщин носителей мутаций BRCA1 или BRCA2 при раке одной молочной железы более оправдано, такая операция уносит ткань-мишень, в которой могут формироваться новые опухоли; то есть операция имеет и лечебный и профилактический смысл.
Объединение современных возможностей онкологии и пластической хирургии позволило разработать целую серию новых одномоментных операций, при которых онкологический этап операции (радикальная мастэктомия, органосохраняющая операция) дополняется пластикой молочной железы.
Как всё это выглядит, спросите Вы?
Вот фотографии больной местно-распространённым раком, сделанные с интервалом около 1,5 лет. Так выглядит женщина после радикальной мастэктомии.
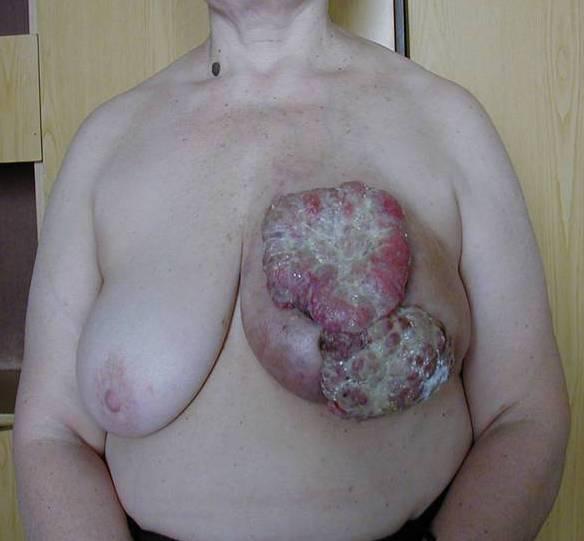
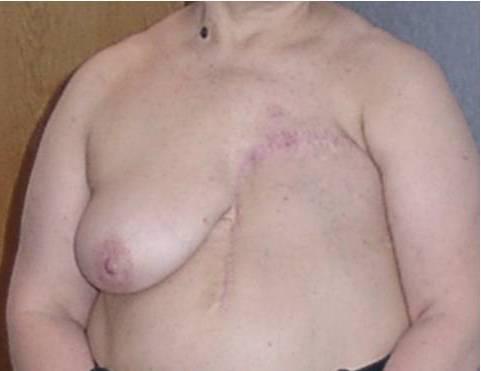
Рисунок 1. До и после радикальной мастэктомии.
Как выглядят женщины после радикальной мастэктомии с реконструкцией молочной железы? Сам я не делаю реконструктивных операций, моё дело – онкологические операции. Для одновременного выполнения радикальной мастэктомии и реконструкции молочной железы приглашаю специалиста по пластической хирургии. Могу похвастаться, что большинство таких операций выполнялось совместно с профессором C.Н.Блохиным. Результаты таких операций можно увидеть на сайте Фрау Клиник.
Что такое органосохраняющие операции? Смысл понятен из названия, удаляется опухоль с запасом здоровых тканей, молочная железа сохраняется. Операция становится радикальным вариантом лечения рака в сочетании с лучевой терапией. Существуют три поколения органосохраняющих операций: 1) широкие клиновидные резекции (США – парциальная мастэктомия, СССР – радикальная резекция, Италия – квадрантэктомия); 2) лампэктомия, 3) онкопластические резекции.
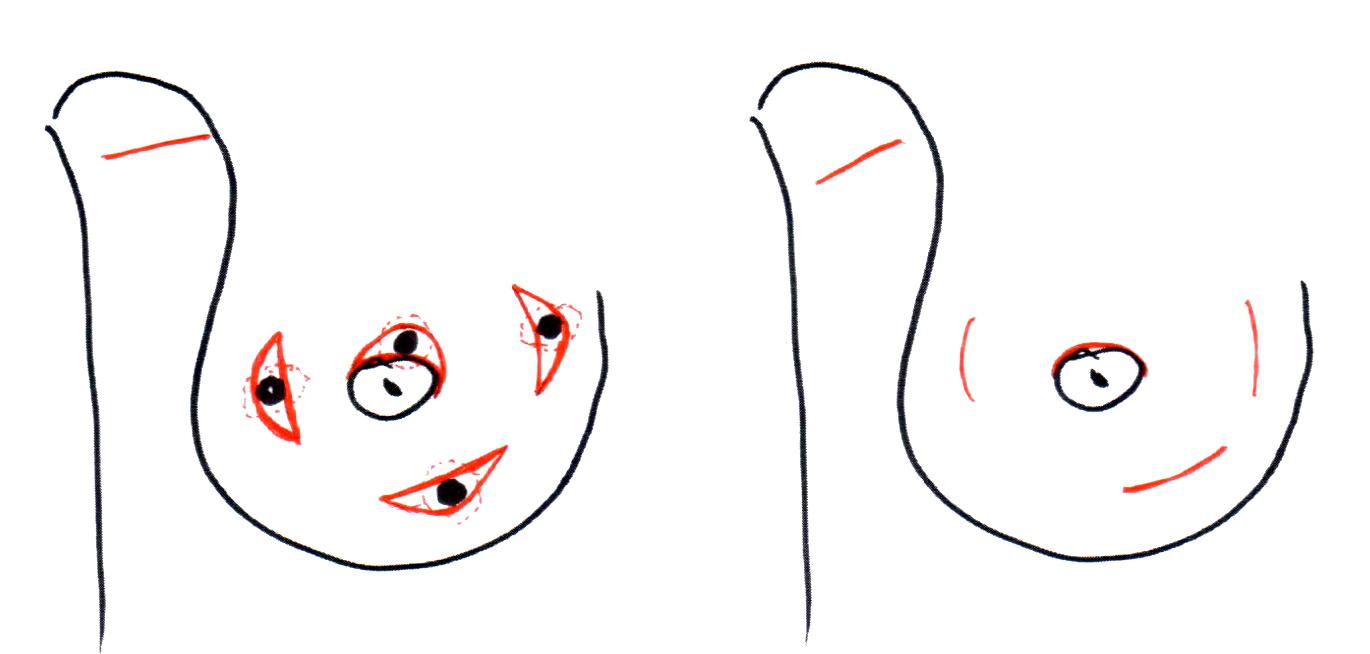
Следующий рисунок демонстрирует схему выполнения операции первого поколения, как правило, объём молочной железы уменьшается на 20-30%, нередко возникает деформация молочной железы. Поэтому операции первого поколения я считаю устаревшими, есть технические решения получше.
Рисунок 2. Схема радикальной резекции.
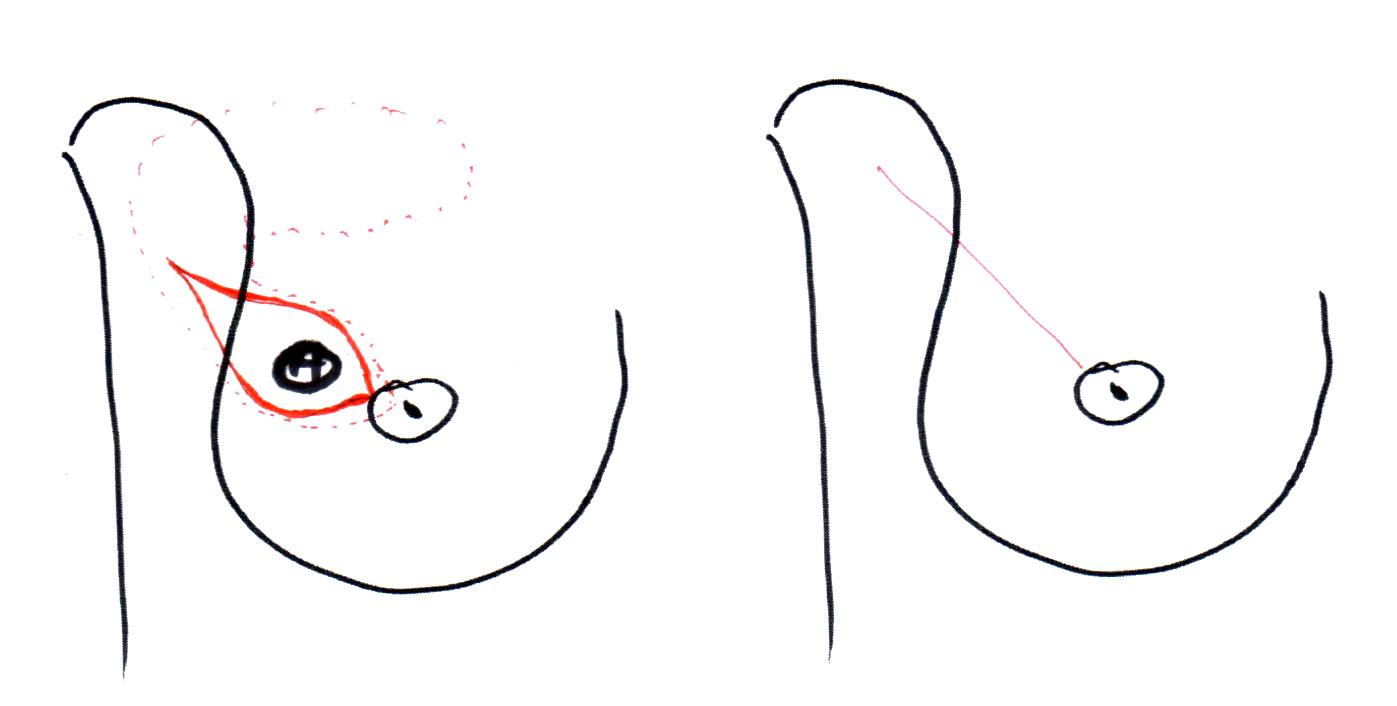
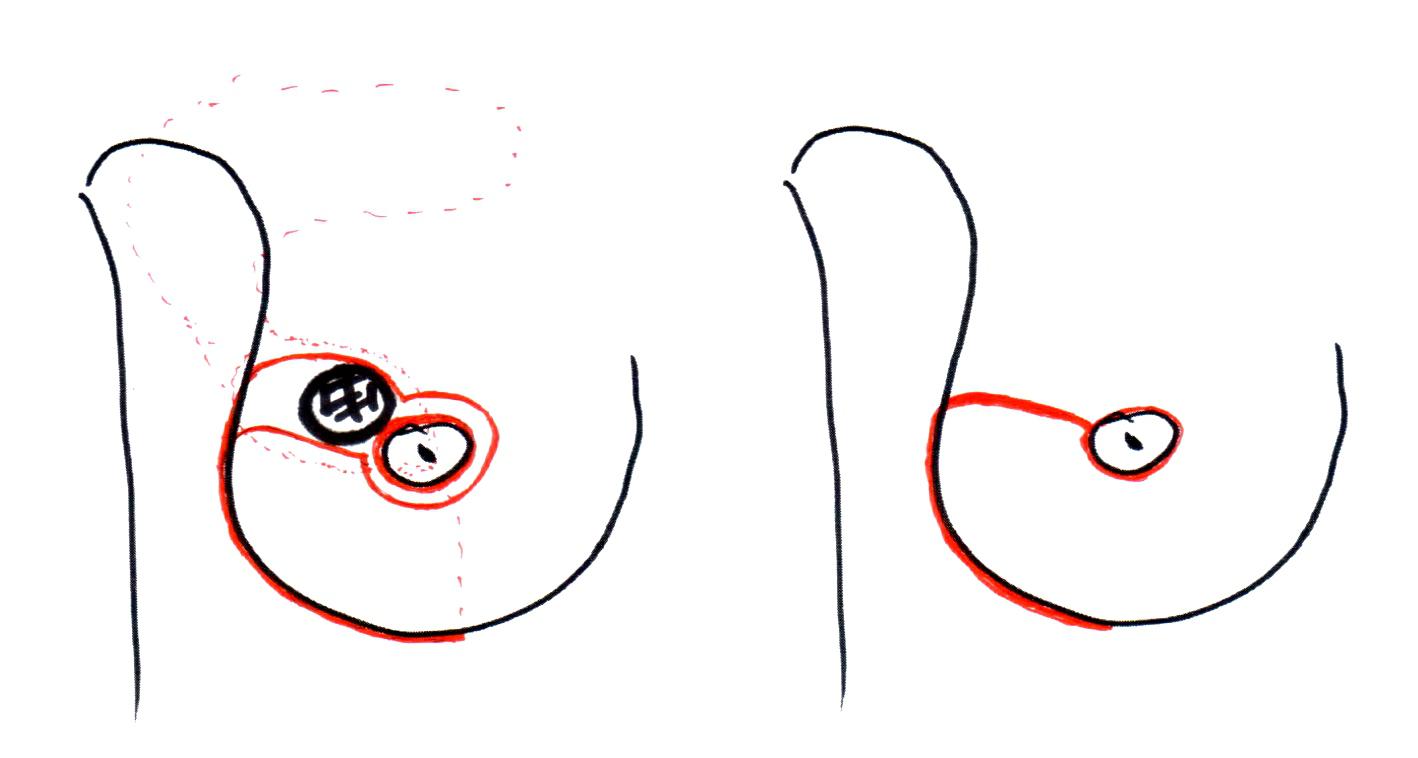
Например, лампэктомия (lump – глыба, кусок, комок) — была разработана в ходе исследований Национального проекта дополнения операций на молочной железе и кишечнике (США, NSABBP). При такой операции выполняли удаление опухоли через дугообразный кожный разрез, ориентированный по кожным складкам
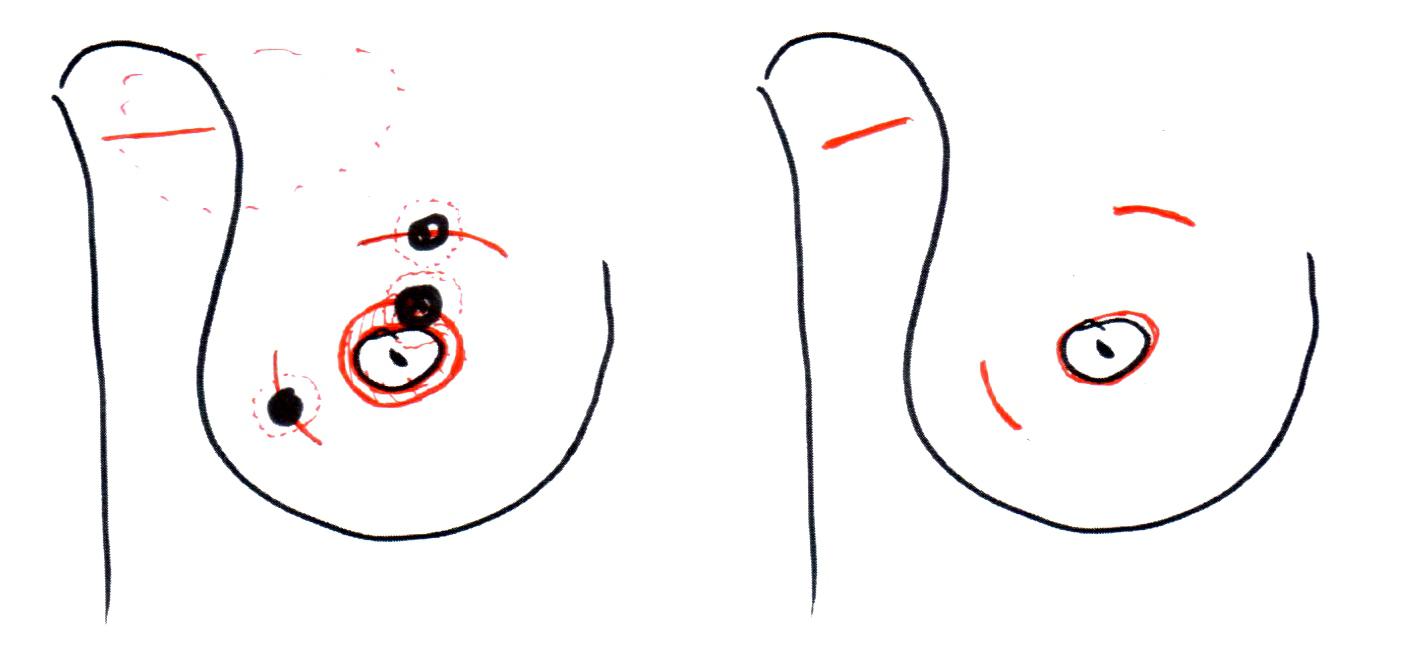
Рисунок 3. Разрезы при лампэктомии с иссечением кожи над опухолью
Рисунок 4. Разрезы при лампэктомии без иссечения кожи над опухолью
Для опухолей небольшого размера (до 1-2 см) лампэктомия остаётся лучшей операцией: нетравматичной и элегантной.
Рисунок 5. Вид через 1 год после лампэктомии.
Для опухолей небольшого размера (до 1-2 см) лампэктомия остаётся лучшей операцией: нетравматичной и элегантной.
При больших размерах опухоли или при её центральной локализации для сохранения формы железы возникает необходимость в привлечении дополнительных усилий по перемещению тканей, и\или вмешательства на противоположной железе для сохранения симметрии, то есть необходимость в выполнении онкопластических резекций. Это большая группа операций, использующих технические решения пластической хирургии. Один из вариантов операции демонстрируют рисунки 6 и 7.
Рисунок 6. Онкопластическая резекция молочной железы с ротацией нижних квадрантов.
Рисунок 7. Онкопластическая резекция молочной железы, выполненная по схеме, показанной на предыдущем рисунке. Вид больной чере 3 г. после операции при локализации опухоли в верхненаружном квадранте.
Радиальная часть рубца скрыта татуажем. Лимфаденэктомия была произведена через разрез на молочной железе.
Облучение молочной железы после органосохраняющих операций позволяет добиться такой же низкой частоты развития местных рецидивов, как и после радикальной мастэктомии. Важно отметить, что проведение правильного органосохраняющего лечения не повышает риск развития отдаленных метастазов, вероятность и скорость их появления остается такой же, как и после радикальной мастэктомии. Пресечь или затормозить этот процесс может только системное профилактическое лечение.
Предполагается, что у значительной части больных на раннем этапе развития рака происходит рассеивание опухолевых клеток током крови по тканям организма. Здесь они могут погибнуть, но, если первичная опухоль не удалена, им на смену придут следующие партии клеток, которые могут сформировать микроскопические колонии.
Современные методы выявления метастазов рака молочной железы не идеальны, с их помощью можно выявить очаг поражения тогда, когда он достиг, по крайней мере, 0,5 см в диаметре. После удаления первичной опухоли дальнейшее поведение микрометастазов определяет судьбу больной. Если микрометастазов вообще нет или они настолько малы, что их развитие блокируется естественными силами организма, наступает длительное излечение. Если микрометастазы малы и растут медленно, рецидив болезни может развиться через десятки лет. Наконец, если микрометастазы относительно крупные и быстро растут, они быстро проявят себя.
Итак, мы видим, что при раке молочной железы наибольшую опасность представляют микрометастазы опухоли, вероятно, рассеянные по всему организму уже к моменту первого обращения к врачу. Естественно, что чем больше местное распространение опухоли (ее размер, вовлечение в опухолевый процесс регионарных лимфатических узлов, кожи молочной железы, грудной стенки), тем больше вероятность существования микрометастазов. Именно поэтому при местно-распространенном РМЖ (III стадии) часто лечение начинается не с местных воздействий на первичную опухоль, а с общего воздействия, чаще всего — с химиотерапии. Значение общего лечения, предпринимаемого после радикальных операций, также чрезвычайно велико для уничтожения микрометастазов и повышения вероятности длительного выздоровления больных. Причем, чем больше стадия болезни, тем хуже прогноз и тем больше оснований к проведению профилактического системного лечения (химиотерапии и эндокринной терапии).
Под химиопрепаратами понимаются вещества природного или синтетического происхождения, обладающие способностями убивать опухолевые клетки. Обычно они вводятся в определенных сочетаниях, позволяющих рассчитывать на успех в 50 — 70% случаев. Химиотерапия обычно проводится за несколько (от 4 до 12) курсов, с интервалами отдыха.
Из средств эндокринного лечения наибольшее применение нашли хирургическое удаление яичников, лекарственное выключение функции яичников, а также препараты, являющиеся гормонами, антигормонами, или ингибиторами образования гормонов. Эти лекарства обычно принимаются длительно и непрерывно, цель их применения — препятствовать стимуляции опухолевого роста собственными гормонами организма. Рецепторы эстрогенов (РЭ) и рецепторы прогестерона (РП) – белковые молекулы в клетках опухоли, воспринимающие воздействие соответствующих женских половых гормонов. Наличие этих молекул говорит о гормональной зависимости опухоли и о возможности снижения вероятности рецидива болезни при проведении гормонотерапии.
Рецептор эпидермального фактора роста 2 типа (HER2) – белковая молекула в опухолевой клетке, воспринимающая стимулирующее действие соответствующего фактора роста. Присутствие этого рецептора, с одной стороны, говорит об очень высокой агрессивности опухоли. С другой стороны, это позволяет применять высокоэффективное средство, по своему механизму действия являющееся антителом к HER2.
В таблице 3 приведены сведения о 10-летней безрецидивной выживаемости больных, получавших лечение в РОНЦ им. Н.Н.Блохина РАМН преимущественно в 80-х годах. По имевшимся тогда стандартам лечения, больным «ранним» РМЖ (T1-2N0M0) не проводилась адъювантная системная терапия.
Таблица 3. 10-летняя безрецидивная выживаемость (БРВ) больных в зависимости от степени распространенности опухоли (данные РОНЦ им. Н.Н.Блохина РАМН).
|
Степень распространенности РМЖ |
10-летняя БРВ в % |
|
T1aN0M0 (опухоль до 0,5 см без поражения регионарных лимфатических узлов) |
93* |
|
T1bN0M0 (опухоль >0,5 до 1.0 см без поражения регионарных лимфатических узлов) |
78* |
|
T1cN0M0 (опухоль >1,0 до 2.0 см без поражения регионарных лимфатических узлов) |
76* |
|
T2N0M0 (опухоль >2,0 до 5.0 см без поражения регионарных лимфатических узлов) |
60* |
|
T1-2N1M0 (опухоль до 5.0 см с одиночными метастазами в подмышечных лимфатических узлах) |
62 |
|
T1-3N2M0 (опухоль любого размера, поражение подмышечных лимфатических узлов с формированием конгломерата) |
48 |
|
T4N1-2M0 (опухоль любого размера с распространением на кожу или грудную стенку с поражением подмышечных лимфатических узлов) |
20-30 |
Примечание: * — без адъювантной системной терапии
Каким образом планировать компоненты профилактического лечения у каждой конкретной больной? Хорошо аргументированные ответы содержатся в рекомендациях Международной конференции по адъювантной терапии рака молочной железы в Сан-Галлене (2011). По современным рекомендациям, практически все больные раком молочной железы после операции нуждаются в проведении профилактического лечения. Для составления индивидуального прогноза и выбора лечения больной принимаются во внимание ее возраст, размер опухоли, степень злокачественности опухоли, наличие опухолевых клеток в перитуморальных сосудах, экспрессия РЭ, РП, HER2 и Ki67, наличие метастазов в лимфатических узлах.