Возможности диагностики, прогнозирования течения и коррекции лечения рака молочной железы с помощью внутритканевого радиофосфорного исследования. Москва, 1992. 54 с.
Мной написана только одна монография в полном смысле этого слова (книга, написанная одним автором). Она основана на личном опыте применения внутритканевой бета-метрии при раке молочной железы. Пациенткам внутривенно вводился 32Р, измерялась интенсивность включения радионуклида в опухоль, этот показатель позволял оценивать пролиферативную активность клеток опухоли, что было полезно для оценки прогноза болезни в разных клинических ситуациях.
Прошу прощения за не всегда успешный дизайн текста, первоначально он был набран в текстовом редакторе “Lexicon”, а представлен в “MicrosoftWord”.
1. Предисловие ……………………….3 стр.
2. Краткий обзор применения 32Р в онкологии ..5 стр.
3. Материалы и методы…………………… 8 стр.
4. Общие закономерности относительного накопления
32Р в опухоли………………………..13 стр.
5. Проблемы диагностики рака молочной железы.25 стр.
6. Прогнозирование рецидива болезни……….28 стр.
7. Оценка эффективности консервативной противоопухолевой терапии………………….32 стр.
8. Оценка операбельности рака III стадии…….38 стр.
9. Оценка безопасности метода………………41 стр.
10. Заключение……………………………43 стр.
Summary………………………………….44 стр.
Источники литературы………………………46 стр.
«Если бы жизнь животного организма была подведена под точные математические законы, то применение наших естественно-научных сведений к индивидуальным случаям не встречало бы тогда никаких затруднений. Практический врач мог бы тогда с точностью механника определить представившиеся ему на том или на другом субъекте расстройства и, согласно с найденным, принять те или другие меры для исправления какого-нибудь недостатка…
С.-Петербург,
Мая 8 дня 1867 года
Сергей Боткин».
Сокращения:
ВР — величина радиоактивности,
ОНРОп — относительное накопление радионуклида (32Р) в опухоли,
ОНРОп1 — исходное ОНРОп,
ОНРОп2 — ОНРОп после противоопухолевой терапии,
РМЖ — рак молочной железы,
РП — рецепторы прогестерона,
РЭ — рецепторы эстрогенов.
1. Предисловие
Объективизация выбора метода лечения, как видно из эпиграфа, является проблемой, возникшей не сегодня. Математизация клинической медицины и, в частности, клинической онкологии в настоящее время чрезвычайно распространена. Это в значительной степени касается составления прогноза для групп больных с различными видами опухолей. Всё большие усилия прилагаются к составлению индивидуального прогноза течения болезни в зависимости от вариаций прогностических факторов, отражающих степень распространённости опухоли, а также её тканевые, клеточные,биохимические и динамические особенности.
К числу факторов прогноза, отражающих динамику опухоли или скорость её роста относится и относительное накопление 32Р в ней. Как известно, в опухолевой ткани фосфор в виде фосфата включается в энергетический обмен, в синтез аденозинтрифосфорной кислоты, нуклеиновых кислот, белков, фосфолипидов, являясь «строительным материалом» для вновь создающихся опухолевых клеток. Интенсивность захвата 32Р опухолевой тканью отражает интенсивность роста опухоли, причём даёт возможность сделать это одномоментно, без лишних затрат времени. Измерение интенсивности захвата 32Р опухолью в различных клинических ситуациях позволяет:
а) прогнозировать скорость развития опухолевой болезни при изучении исходного показателя,
б) оценивать эффективность противоопухолевой консервативной терапии в тех случаях, когда сохраняется остаточная опухоль и не представляется возможным оценить её природу и дальнейшую судьбу (активно растущая опухоль?, опухоль в состоянии инволюции?, рубец на месте опухоли?, лучевой фиброз?);
в) оценивать операбельность, то есть вероятность быстрого развития местнорегионарного рецидива опухоли, после проведенного предоперационного лечения.
Наши исследования проводились в отделении опухолей молочных желёз (заведующий отделением профессор В.П.Летягин) и отделении общей онкологии (заведующий д.м.н. К.П.Лактионов) при содействии научных сотрудников лаборатории радиоизотопной ди-
агностики (руководитель профессор Р.И.Габуния) Научно-исследовательского института клинической онкологии Всесоюзного онкологического научного центра АМН СССР (директор академик АМН Н.Н.Трапезников), а также научных сотрудников Физикотехнического института им.А.Ф.Иоффе АН СССР. Выражаю глубокую благодарность за поддержку в работе сотрудникам перечисленных лабраторий и отделений.
2. Краткий обзор применения 32Р в онкологии
32Р почти, что забыт современной онкологией, поэтому уместно будет привести основные сведения о его применении.
32Р является чистым бета-излучателем. Средняя энергия бета-частиц равна 0,69 Мэв. Период полураспада составляет 14,3 дня, период полувыведения колеблется от 8 до 12 дней. Средний пробег бета-частицы в ткани — 3 мм. 32Р вводится внутривенно
или внутрибрюшинно, или принимается через рот в виде раствора двузамещённого фосфата натрия — Na2HPO4.
ВР 32Р, применявшаяся различными авторами для диагностических исследований широко варьирует. Можно отметить общую тенденцию к её снижению до 37 — 74 кБк/кг (2, 4 10, 13, 18).
Имеются сведения и о применении более высоких величин: около 250 кБк/кг — (33), 370 кБк/кг — (23), 370 — 888 кБк/кг (39). Для сравнения: ВР 32Р, применяющиеся в лечебных целях при истинной полицитемии, раке яичников, диссеминированном РМЖ, составляют 4 — 5 МБк/кг (31, 37, 43), то есть на 1 — 2 порядка больше, чем при диагностических исследованиях.
Распределение 32Р в тканях изучалось в 40-х годах, так, было показано в экспериментах на крысах (4), что в первые 12 часов после введения препарата наибольшее удельное количество радиоактивности наблюдалось в печени, почках, мышечной ткани.
Через 65 часов наибольший уровень радиоактивности наблюдался в мышцах, селезёнке, почках, костях. При исследованиях на мышах с перевивным РМЖ, лимфомой и лимфосаркомой в первые часы после введения 32Р наблюдали наибольший уровень включения радионуклида в печень, почки, тонкий кишечник. Через несколько часов уровень включения 32Р в указанные органы снижался, наибольший уровень радиоактивности устанавливался в опухолях (30). Было установлено также, что ткань кроветворных органов активно захватывает данный радионуклид (17).
В клетке 32Р в виде фосфата включается в процессы гликолиза, идёт на синтез аденозинтрифосфорной кислоты, дезоксирибонуклеиновой кислоты, рибонуклеиновой кислоты, белков, фосфолипидов (21, 42).
Применение 32Р для нужд диагностики опухолей столкнулось с его несоответствием критериям, предъявляемым (7) к радиофармакологическим препаратам: низкая радиотоксичность — 32Р радиотоксичен, по оценке R.P.Spenser (42) при введении 1 мКи (37 МБк) препарата пациент получает около 15 рад общего облучения всего тела;относительно короткий период полураспада — у 32Р период полураспада относительно велик, — 14,3 суток; удобное для регистрации гамма-излучение — 32Р — «чистый» бета-излучатель, очень существенны проблемы, связанные с бета-радиометрией; необходимые биологические свойства — 32Р не туморотропен, включается во все органы и ткани, особенно — в печень, костный мозг, эпителий кишечника.
У больных, получавших терапевтические величины активности 32Р, наблюдались осложнения, связанные с миэлотоксичностью, — лейкопения, тромбоцитопения, анемия (31, 37, 43, 39). Ведение 32Р в слюнные железы в виде коллоидного фосфата хрома у крыс
Wistar у 64% животных приводило к развитию сарком, карцином и карциносарком в месте инъекции в срок до 7 месяцев; таким образом показана канцерогенность 32Р (25).
Оценка диагностических возможностей внутритканевой бета-радиометрии с помощью игловидного бета-детектора была произведена А.К.Непесовым (12), автор высоко оценивает точность,
чувствительность и специфичность инвазивного исследования.
У больных злокачественными опухолями определение относительного накопления 32Р в опухоли может оказаться полезным для прогнозирования течения, а также оценки эффективности консервативного лечения опухолей. Предпосылки такого применения 32Р имеются в литературе (1, 10, 24, 34), использование инвазивного исследования может позволить измерять истинные величины накопления 32Р в опухоли.
Сведения литературы об использовании 32Р для диагностики опухолей и для оценки эффективности противоопухолевого лечения приведены в соответствующих главах.
3. Материалы и методы
Работа основана на анализе исследований 148 больных РМЖ,(в том числе — 4 мужчин), 2 больных саркомами молочной железы и 8 больных доброкачественными заболеваниями молочной железы.
Все диагнозы подтверждены результатами морфологических исследований. Среди доброкачественных заболеваний у 2 больных имели место 4 фиброаденомы, у 4 больных была пролиферативная форма
фибрознокистозной болезни, у 2 — непролиферативная форма фибрознокистозной болезни. В одном из 2 случаев сарком наблюдалась лейомиосаркома, во втором — нейрогенная саркома.
Из 144 женщин, больных РМЖ, 78 были репродуктивного периода, 66 находились в менопаузе. Распределение больных по степени распространённости рака: I стадия (T1N0M0) — 21, II стадия (T2N0-1M0, T1-2N1M0) — 48, III стадия (T1-4N2-3M0,
T3-4N0-3M0) — 72, IV стадия (T1-4N0-3M1) — 4; у 3 больных имел место двусторонний синхронный РМЖ. В 27 случаях диагноз рака был подтверждён только результатом цитологического исследования пунктата из опухоли, в 124 — результатами гистологического
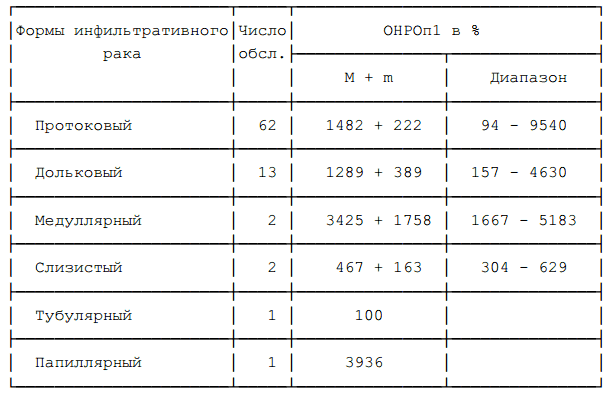
исследования. В 62 случаях имел место протоковый инфильтративный рак, в 13 случаях — дольковый инфильтративный рак, в 2 случаях — медуллярный рак, в 2 случаях — слизистый рак, в 1 случае — тубулярный рак, в 1 случае — папиллярный рак, в 43 случаях морфологическая форма рака не уточнена из-за патоморфоза различной степени выраженности. Цитологические исследования производились в лаборатории цитологии (руководитель -проф.Н.Н.Петровичев), морфологические исследования производились в лаборатории патоморфологии (руководитель — акад. АМН СССР
Ю.Н.Соловьёв) ВОНЦ АМН СССР.
Определение уровня РЭ и РП в ткани РМЖ производилось в лаборатории клинической биохимии (руководитель — проф. Л.С.Бассалык) ВОНЦ АМН СССР. Рецепторопозитивными считались опухоли,
имеющие уровень рецепторов 10 и больше фмоль/мг.
Лечение РМЖ I и II стадий (T1-2N0-1M0), как правило, начиналось с оперативного лечения в объёме модифицированной радикальной мастэктомии (Patey & Disson), либо органосохраняющей операции. В последнем случае проводилось послеоперационное облучение молочной железы, в большинстве случаев — с облучением
зон регионарного метастазирования. Всем больным с метастатическим поражением лимфатических узлов, а также части больных без такового проводилось профилактическое системное лечение (химиотерапия, эндокринная терапия).
Больным РМЖ III стадии (T1-2N2M0 и T3-4N0-2M0) лечение начиналось с химиотерапии или лучевой терапии, или с химиолучевой терапии. Абсолютное большинство больных было переведено в операбельное состояние и им была произведена модифицированная радикальная мастэктомия (Patey & Disson). Всем больным
проводилась адъювантная химиотерапия, больные с рецепторопозитивными опухолями получали ещё и адъювантную эндокринную терапию.
32 больные РМЖ I — III стадий в связи с выраженными сопутствующими заболеваниями или в связи с отказом от операции получали лучевую терапию по радикальной программе с подведением на опухоль суммарной очаговой дозы 65 -80 Гр, на молочную железу — 60 — 70 Гр, на подмышечную область — 50 — 60 Гр, на надключичную и парастернальные области — 40 — 50 Гр. Лечение
дополнялось эндокринной терапией или сочетанием эндокринной и химиотерапии.
Больным РМЖ IV стадии (T1-4N0-2M1) проводилось консервативное комплексное лечение, включавшее лучевую терапию, химиотерапию и эндокринную терапию. Больным саркомами и доброкачественными заболеваниями молочных желёз проводилось хирургическое лечение.
У 112 больных РМЖ в 115 первичных опухолях, во всех случаях доброкачественных заболеваний и сарком до начала противоопухолевого лечения определялось ОНРОп1 внутритканевым методом, у 3 больных с поверхностным поражением (рак Педжета соска, метастатическое поражение кожи, изъязвление опухоли) исследование осуществлялось методом наружной радиометрии.
У 62 больных РМЖ в разные сроки после консервативного противоопухолевого лечения (лучевого, химиотерапевтического, эндокринного) внутритканевым методом определено ОНРОп2.
Определение ОНРОп осуществлялось с помощью полупроводникового бета-детектора, представленного для испытаний сотрудниками Физико-технического института им.А.Ф.Иоффе АН СССР.
Определение ОНРОп1 осуществлялось следующим образом.
1. До начала какого либо противоопухолевого лечения больным внутривенно вводился двузамещенный фосфат натрия, меченный Р32, активностью 37 — 185 КБк/кг (1 — 5 мкКи/кг). Исходной была ВР 185 КБк/кг (5 мкКи/кг), в процессе работы ВР радионуклида была снижена до 37 — 74 КБк/кг (1 — 2 мкКи/кг).
2. Игольчатым бета-детектором измерялась фоновая радиоактивность трижды по 100 секунд: а1, а2, а3. Вычислялась средняя арифметическая
а = (а1 + а2 + а3)/ 3
3. Больной, обнаженной по пояс, в положении лёжа на спине 5% спиртовым раствором йода обрабатывалась кожа молочных желез. О,5% раствором новокаина анестезировалась кожа на участке, симметричном опухоли и кожа над опухолью. Иглой диаметром
1,5 — 2,О мм перфорировалась кожа здоровой молочной железы, игольчатый бета-детектор внедрялся в ткань железы на участке, симметричном опухоли, трижды измерялось число импульсов за интервалы по 1ОО секунд: b1, b2, b3. Бета- детектор извлекался, вычислялась средняя арифметическая
b = (b1 + b2 + b3)/3
4. Иглой диаметром 1,5 — 2,О мм перфорировалась кожа больной молочной железы, бета-детектор внедрялся в опухоль, трижды измерялось число импульсов за интервалы по 1ОО секунд: c1, c2, c3. Бета- детектор извлекался. Кожа в местах пункций
обрабатывалась раствором йода. Вычислялась средняя арифметическая
с = (с1 + с2 + с3)/3
5. Вычислялось ОНРОп1 в процентах по формуле:
ОНРОп1 = (с — а) х 100/b — a
Определение ОНРОп2 производилось аналогичным образом, но в других клинических ситуациях, чаще всего — у больных после консервативного противоопухолевого лечения с целью уточнения эффективности лечения или оценки операбельности при раке III стадии после предоперационной терапии.
При низких скоростях счёта, что нередко наблюдалось при снижении вводимой ВР радионуклида до 37 кБк/кг, возникала необходимость дополнительного измерения счёта длительностью 300 — 1000 секунд. В 41 случае определение ОНРОп1 производилось на операционном препарате, что позволяло под контролем глаза контролировать локализацию бета-детектора, уровень радиоактивности опухоли сравнивался с максимально удалённым от неё участком нормальной ткани молочной железы. У 3 больных с поверхностным
поражением (рак Педжета соска, 4 0метастатическое поражение кожи, изъязвление опухоли) исследование ОНРОп1 производилось путём наружной бета-радиометрии. При этом уровень относительного накопления 32Р вычислялся относительно радиоактивности кожи симметричного участка здоровой молочной железы. Определение ОНРОп2 производилось только внутритканевым методом.
С целью ориентации в распределении 32Р в нормальной ткани молочной железы в зависимости от ВР радионуклида и сроков исследования после его введения дополнительно вычислялось соотношение b/a , то есть соотношение радиоактивности нормальной ткани к фоновой радиоактивности.
4. Общие закономерности относительного накопления
32Р в опухоли
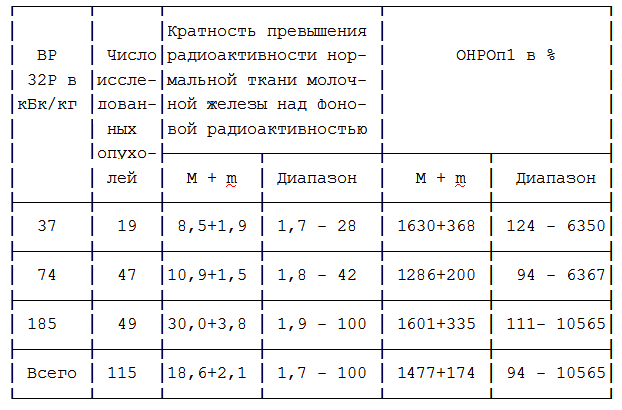
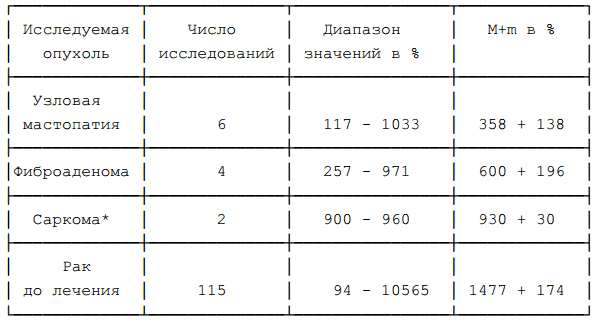
Средние величины ОНРОп1, определённого инвазивным методом, составили 1477+174% (см. табл.1), ОНРОп1, определённого методом наружной детекции — 198+27%; ОНРОп2 — 486+81% (различия статистически значимы, Р<0,01) с диапазоном 9 — 4383%.
ВР, применявшаяся (12) для внутритканевой бета-радиометрии с целью диагностики РМЖ, составляла 185 кБк/кг. Мы использовали 32Р с ВР 185, 74 и 37 кБк/кг, как видно из таблицы 1, различий уровня ОНРОп от ВР не наблюдается, все применявшиеся ВР приемлемы для измерения ОНРОп. Каких-либо преимуществ при
введении 185 кБк/кг не было получено, что позволило отказаться от этой ВР в пользу меньших.
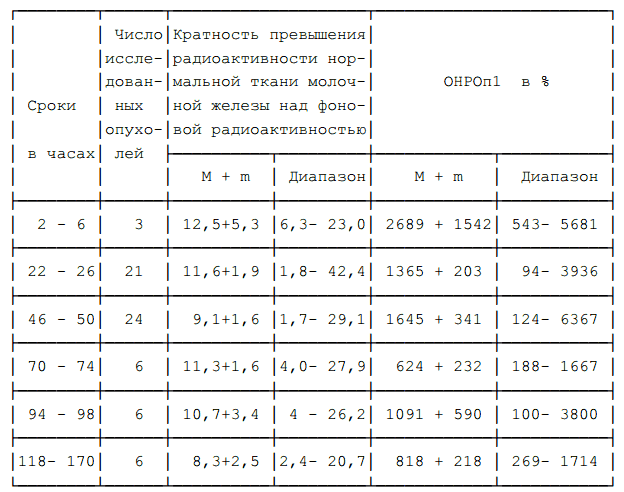
Сроки исследования после введения 32Р изучались нами так же, как и многими предшественниками (1, 2 и др.). Из таблиц 2 и 3 видно, что в интервале 2 — 170 часов проведение исследования вполне возможно, однако, начиная с третьих суток после введения радионуклида отмечается тенденция к снижению ОНРОп.
Поэтому мы считаем желательным выполнение бета-радиометрии в первые 50 часов после введения 32Р.
Таблица 1. ОНРОп1 инвазивным методом и превышение фоновой радиоактивности в нормальной ткани молочной железы при варьировании вводимой величины радиоактивности (ВР) 32Р.
Таблица 2. ОНРОп1 и превышение фоновой радиоактивности в нормальной ткани молочной железы при инвазивном исследовании через разные сроки после введения 37 — 74 кБк/кг 32Р.
Таблица 3. ОНРОп1 и превышение фоновой радиоактивности в нормальной ткани молочной железы при инвазивном исследовании через разные сроки после введения 185 кБк/кг 32Р.
Важным преимуществом внутритканевой бета-радиометрии и, в частности, внутриопухолевого расположения бета-детектора, является качественное повышение эффективности счёта. Так, при накожном радиофосфорном исследовании с помощью сцинтилляционного бета-счётчика средние значения ОНРОп при РМЖ составили 161,0 + 7,0% (1). В нашем исследовании средние значения ОНРОп1 при внутриопухолевой бета-радиометрии составили 1477+174%; при наружной бета-радиометрии — 198+27%. Столь высокие различия
— 17 —
эффективности счёта легко объяснимы при учёте средней длины пробега бета-частиц, испускаемых 32Р, в тканях (3 мм). Большинство наших исследований произведено внутритканевым методом, при котором бета-детектор вводился в центр опухоли, что обеспечивало оптимальные пространственные соотношения бета-детектора и опухолевой ткани.
Аналогичные различия величин относительного накопления 32Р в зависимости от соотношения опухоли и бета-счётчика наблюдали и другие авторы. Так, было показано (23), что уровень ОНРОп, определяемый на операционном препарате, может на поря-
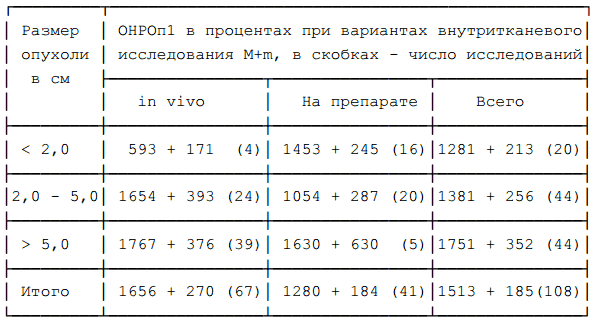
Таблица 4. ОНРОп1 инвазивным методом в зависимости от варианта внутритканевого исследования и размеров опухоли.
Примечание: различия величин статистически не значимы.
док превышать таковой, определённый с помощью наружной детекции. Методической особенностью предшествовавшей работы по инвазивной бета-радиометрии (12) была вариабельность соотношения опухоли и бета-детектора, как пишет автор, «При помощи игольчатого бета-зонда мы могли подойти вплотную к опухоли и
даже войти в неё». У всех обследованных 42 больных раком молочной железы наблюдалось относительное накопление 32Р, превышающее 135%, у 10 больных (24%) ОНРОп превышало 200%. При нашей методике уровень ОНРОп1, превышающий 200%, был получен в 90% случаев.
Из таблицы 4 видно, что статистически значимых различий величин ОНРОп1 в зависимости от применяемого варианта внутритканевого исследования не наблюдается, то есть бета-радиометрия, осуществляемая in vivo, правильно отражает истинный уровень радиоактивности тканей. В то же время, нельзя не отметить явную тенденцию к снижению уровня ОНРОп1 при исследовании опухолей < 2 см in vivo. По-видимому это связано с недостаточно точным попаданием чувствительной части бета-зонда в центр столь небольших опухолей.
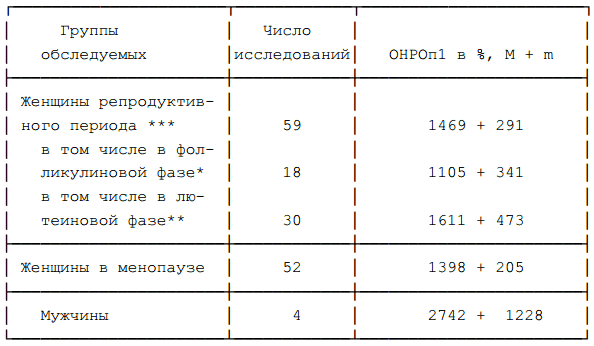
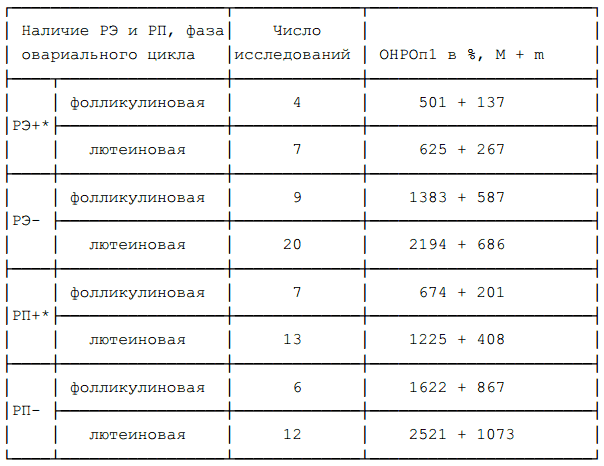
Можно отметить тенденцию к повышению среднего уровня ОНРОп1 у женщин, обследованных в лютеиновую фазу цикла, когда уровень эстрогенов и прогестерона в крови повышен, по сравнению с женщинами, обследованными в фолликулиновую фазу (смотри таблицу 5). У мужчин средние значения ОНРОп1 несколько выше, чем у женщин.
Таблица 5. Уровень ОНРОп1 в зависимости от пола, а у женщин от репродуктивного статуса и фазы овариального цикла.
Примечание: * — с 2 по 10 день овариально-менструального цикла, ** — с 14-15 по 28 — 30 день овариально-менструального цикла. Различия статистически не значимы. *** — включая женщин с нарушениями овариально-менструального цикла, в том числе климактерическими, а также женщин, обследованных в 11 — 13 дни цикла.
Больные с обширным метастатическим поражением регионарных лимфатических узлов (N2) и больные с отдалёнными метастазами (M1) имели средние значения ОНРОп1 большие, чем больные не имевшие отдалённых и регионарных метастазов (N0M0) или имевшие одиночные подмышечные метастазы (N1M0, смотри таблицу 6).
Таблица 6. ОНРОп1 в % (M + m) в зависимости от вариантов N и М, в скобках указано число больных.
Примечание:* — статистически значимые различия в сравнении с группами больных, имевших N0M0 и N1M0, P<0,05.
У больных с различными морфологическими формами рака не обнаружено закономерных различий уровня ОНРОп1, однако, так же, как и в предшествовавших исследованиях (33) нами отмечена тенденция к снижению ОНРОп1 при слизистом раке (смотри таблицу 7). Очевидно, что корреляции уровня ОНРОп1 с одной из двух наиболее частых форм РМЖ — протоковым раком и дольковым раком не прослеживается. Любопытны случаи высокого уровня ОНРОп при редких формах РМЖ: медуллярном и папиллярнном раке, для которых характерно относительно благоприятное течение болезни (9), однако небольшое число наблюдений не позволяет считать такое сочетание закономерностью.
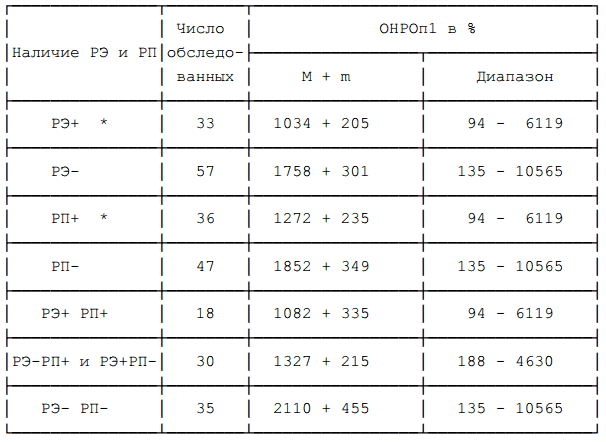
Тенденция к более высоким средним значениям ОНРОп1 наблюдалась у больных с рецепторонегативными опухолями как по РЭ, так и по РП. Высокий уровень ОНРОп1 так же (смотри главу 6), как и отсутствие РЭ и РП в опухоли являются прогностическими признаками быстрого возврата болезни (27). По нашим данным (смотри таблицу 8) прослеживается тенденция к взаимосвязи этих признаков, однако более точно это может быть установлено при анализе связи этих факторов с безрецидивной выживаемостью.
Таблица 7 ОНРОп1 в зависимости от гистологической формы рака.
Примечание: статистически значимых различий уровня ОНРОп1 не обнаружено.
Таблица 8. ОНРОп1 в зависимости от наличия РЭ и РП.
Примечание: * — уровень рецепторов равен или больше 10 фмоль/мг. Различия средних величин статистически не значимы.
Таблица 9 демонстрирует наличие двух видов эндокринных воздействий, по-видимому, оказывающих некоторое влияние на величину ОНРОп1: наличия или отсутствия РЭ и РП в опухоли и фазы овариального цикла. Интересно отметить, что в лютеиновой фазе,
Таблица 9 ОНРОп1 в зависимости от наличия РЭ, РП и фазы овариального цикла.
Примечание: * — уровень рецепторов равен или больше 10 фмоль/мг. Различия средних величин статистически не значимы.
когда уровень эстрогенов и прогестерона повышается, возрастание средних величин ОНРОп1 наблюдается как в рецепторопозитивных, так и в рецепторонегативных опухолях.
Таким образом, средние величины ОНРОп1, определяемого при внутриопухолевом расположении бета-детектора, существенно выше, чем при внеопухолевой бета-радиометрии. Активность радионуклида 37 — 74 кБк/кг позволяет получить значения ОНРОп1, аналогичные таковым при дозе 185 кБк/кг. Вариации величины активности 32Р и длительности интервала между введением 32Р и бета-радиометрией в пределах 2 — 170 часов статистически значимо не влияют на величину ОНРОп1. Наблюдается тенденция к некоторому снижению средних величин ОНРОп1 при исследованиях, проводимых через 70 часов и больше после введения 32Р.
Можно констатировать, что уровень ОНРОп1 при раке молочной железы: не связан с размером опухоли; выше у больных с N2 по сравнению с больными, у которых отсутствует метастатическое поражение регионарных лимфатических узлов или степень такого
поражения характеризуется как N1. Имеется тенденция к повышению ОНРОп1: у больных с рецепторонегативными по РЭ опухолями по сравнению с больными с РЭ-позитивными опухолями, у больных с рецепторонегативными по РП опухолями по сравнению с больными с РП-позитивными опухолями, у больных, обследованных в лютеиновую фазу цикла, по сравнению с больными, обследованными в фолликулиновую фазу цикла.
Величина ОНРОп1 колеблется в широких пределах; учитывая, что интенсивность включения 32Р в опухолевую ткань, по-видимому, связана с интенсивностью пролиферативных процессов в ней, представляет интерес изучение величины ОНРОп1 как фактора прогноза. Средние значения ОНРОп2 статистически значимо ниже средних значений ОНРОп1, величины ОНРОп2 варьируют в широком диапазоне, что предполагает возможность изучения ОНРОп2 как критерия оценки эффективности противоопухолевого лечения.
5. Проблемы диагностики рака молочной железы
Метод радиофосфорной диагностики рака молочной железы (РМЖ) был предложен в 1946г. V.A.Low-Beer с соавт. (33). Последовало большое количество исследований, посвящённых проблемам диагностики РМЖ с использованием счётчиков Geiger-Muller в 50 — 60-х годах (смотри обзоры 1, 11, 42). Известно также применение полупроводниковых бета-детекторов при диагностике опухолей других локализаций (3, 12, 13-15, 39).
После 6 лет исследований V.A.Low-Beer & R.B.Green (34)оценили результаты работы с определённой долей критики: «Метод диагностики позволяет ориентироваться хирургу перед операцией, но никогда не заменит биопсии.» При наличии таких методов диагностики РМЖ как маммография и цитологическое исследование, радиофосфорная диагностика РМЖ оказалась ненужной в клинической практике.
Несоответствие 32Р требованиям радиационной гигиены, предъявляемым к радионуклидам, используемым в диагностических процедурах, также способствовало отказу от него, так как широкое применение его для диагностики опухолей сопряжено с облучением пациентов, в том числе и не болеющих злокачественными опухолями.
Определённый энтузиазм относительно диагностических возможностей внутритканевой бета-радиометрии с помощью игловидного полупроводникового бета-детектора при диагностике РМЖ был высказан А.К.Непесовым (12), автор высоко оценивает точность, чувствительность и специфичность инвазивного исследования.
Поддерживая сложившееся в литературе критическое отношение к радиофосфорной диагностике РМЖ, мы применяли 32Р у больных с диагностированным РМЖ для прогнозирования течения болезни. У части больных диагноз рака был отвергнут при гистологи-
Таблица 10. Относительное накопление 32Р в опухолях молочных желёз при внутриопухолевом исследовании.
* — в 1 случае — лейомиосаркома, в 1 случае – нейрогенная саркома.
ческом исследовании, таким образом был получен материал для оценки специфичности радиофосфорного исследования.
Кратко повторив уже цитируемое исследование (12), отметим, что его методической особенностью была вариабельность соотношения опухоли и бета-детектора. Автор воспользовался диагностическим критерием злокачественности, разработанным ранее
для наружной бета-радиометрии (1) и равным 135%. У всех обследованных 42 больных РМЖ наблюдалось относительное накопление 32Р превышающее 135%, у 10 больных (24%) ОНРОп превышало 200%.
При исследовании 14 доброкачественных опухолей в 12 случаях был получен уровень ОНРОп < 135%, а в 2 случаях — >135%.
Таблица 11. Выбор диагностического уровня ОНРОп1.
Как было указано выше, особенностью нашей методики было внедрение чувствительной части бета-зонда в опухоль. При этом уровень ОНРОп1, превышающий 200%, был получен в 90% раковых опухолей. Однако это не сказалось на повышении точности диагностики, так как при доброкачественных поражениях уровень ОНРОп1 оказался неожиданно высоким (смотри таблицы 10, 11).
Можно видеть, что, несмотря на высокую чувствительность исследования при диагностическом уровне ОНРОп1=135%, правильнее говорить не о возможностях метода, а о невозможности применения метода для диагностики РМЖ из-за высокого уровня ОНРОп1, наблюдаемого при доброкачественных заболеваниях.
6. Прогнозирование рецидива болезни
Среди огромного количества факторов, имеющих прогностическое значение для течения РМЖ, можно выделить следующие их группы: а) факторы, характеризующие степень распространённости опухоли; б) факторы, характеризующие тканевую и
клеточную структуру опухоли; в) биохимические и антигенные характеристики опухоли; г) показатели иммунологической реактивности организма; д) факторы, оценивающие скорость роста опухоли.
В настоящей работе мы хотим привлечь внимание к последней группе факторов прогноза. Оценка скорости роста опухоли производится самыми разными методами, начиная от анализа длительности существования симптомов. Наиболее точным и прямым методом является изучение динамики роста опухоли на основании маммографических исследований через значительные интервалы времени. Вычисление исходного и конечного объёмов опухоли даёт возможность определить время удвоения опухоли (26). Период удвоения опухоли остаётся важной биологической характеристикой для
остающихся после радикальной операции микрометастазов, от темпа их роста зависит время появления выявляемых метастазов и показатели выживаемости больных (32).
Косвенная оценка скорости роста опухоли основана на изучении интенсивности пролиферации опухолевых клеток путём: вычисления процента клеток, находящихся в митозе, то есть митотического индекса (20); определения доли клеток, находящихся
вне фазы покоя, в частности — в S-фазе, с помощью проточной цитометрии (22, 40); определения интенсивности включения 3Н-тимидина в опухолевые клетки in vitro (29, 35, 36, 41).
Наиболее близок по биологическому смыслу к методу индекса метки с применением 3Н-тимидина метод, который мы предлагаем в настоящей работе. Так же, как и 3Н-тимидин, 32Р в виде фосфата интенсивно включается в синтетические процессы в клетке, в том числе и в синтез нуклеиновых кислот (21).
Предпосылки использования уровня включения 32Р в опухоль для прогнозирования течения болезни можно найти уже в пионерской работе Low-Beer B.V.A. с соавторами (33), отметивших, что, в отличие от большинства РМЖ, медленно растущая опухоль накапливает такое же количество радионуклида, как и нормальная
ткань. Позже, в экспериментах на мышах была обнаружена прямая корреляция между уровнем включения 32Р в опухоли и скоростью их роста (19).
Наконец в наблюдении В.З.Агранат была продемонстрирована прямая зависимость интенсивности захвата 32Р опухолями околоушной слюнной железы от скорости их роста (1).
В настоящее время мы можем оценить значение ОНРОп1 как фактора прогноза только у больных РМЖ III стадии, поскольку при РМЖ I и II стадий процесс метастазирования развивается медленнее и к настоящему времени для оценки прогностического значения этого показателя при РМЖ I и II стадий прослежено в течение длительного периода недостаточное количество больных.
Безрецидивная выживаемость анализирована у 37 больных РМЖ III стадии, получавших однотипное лечение, включавшее лучевую терапию, химиотерапию, операцию в обьеме радикальной мастэктомии с сохранением большой грудной мышцы, эндокринную терапию, профилактическую химиотерапию и эндокринную терапию по общим принципам. Все больные прослежены в сроки от 1,5 до 4 лет, что
позволило достоверно вычислить показатели двухлетней безрецидивной выживаемости и провести ретроспективный анализ безрецидивной выживаемости больных в группах с ОНРОп1 ниже критического уровня и с ОНРОп1 выше критического уровня.
Методом построения таблиц дожития были вычислены кривые безрецидивной выживаемости в двух сравниваемых группах больных. Результат анализа приведен на рисунке 1, достоверность различий вычислялась по методу Х2 (Mantel N., Haenszen W.).
Как видно из рисунка 1, опухоли с высоким уровнем ОНРОп1 достоверно быстрее рецидивируют, чем опухоли с низким уровнем ОНРОп1, различия показателей статистически значимы, Р<О,О2.
Можно предположить, что различия в безрецидивной выживаемости могли быть связаны с различием в степени исходной распространенности опухоли в пределах III стадии в сравниваемых
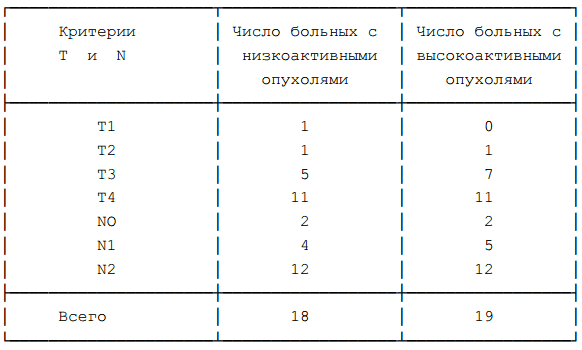
Таблица 10. Распределение больных по критериям Т и N в группах с низко- и высоко- активными опухолями.
группах больных. Таблица 10 опровергает это предположение, распределение больных в сравниваемых группах практически одинаково.
Прогнозирование течения рака молочной железы имеет важное значение для правильного планирования профилактического лечения больных, перенесших радикальное лечение. Широко распространено использование в качестве факторов прогноза клинических и морфологических признаков, характеризующих степень распространености опухоли в период проведения первичного лечения: размер первичной опухоли, наличие метастазов в лимфатических узлах, число пораженных лимфатических узлов, наличие опухолевых клеток в лимфатических и кровеносных сосудах. Дополнительными к этой группе факторов прогноза выступают характеристики опухоли, позволяющие прямым или косвенным образом оценить скорость её роста.
Дальнейшие исследования смогут взвесить ценность и необходимость изучения каждого из факторов прогноза. Результаты настоящей работы, которые мы расцениваем как предварительные, демонстрируют тот факт, что определение ОНРОп1 позволяет выделить быстро рецидивирующие опухоли и медленно рецидивирующие опухоли. Для больных раком молочной железы III стадии с ОНРОп1, превышающим критический уровень, вероятность безрецидивной выживаемости на протяжении ближайших 2 лет составляет 55,1+ 12,1%; для больных с ОНРОп1 ниже критического уровня вероятность безрецидивной выживаемости на протяжении 2 лет составляет 94,1 + 5,7%.
7. Оценка эффективности консервативной противоопухолевой терапии
Проведение консервативного лечения первичного рака молочной железы лучевыми, химиотерапевтическими, эндокринными воздействиями сталкивается с проблемой оценки эффективности. Это связано с тем, что после проведения эффективного лечения может наблюдаться остаточная опухоль или уплотнение, связанное с фиброзом тканей. Дифференцировка этих состояний нередко сложна и основана на клиническом, ультразвуковом и (или) рентгенологическом обследовании больных в динамике.
Общепринятый метод оценки эффективности терапии солидных опухолей имеет следующие градации: полный эффект — подразумевается исчезновение опухоли на срок не менее, чем 1 месяц; частичный эффект — уменьшение размеров опухоли не менее, чем на 50% на срок не менее, чем 1 месяц; стабилизация — уменьшение размеров опухоли менее, чем на 50% или увеличение размеров менее, чем на 25% на срок не менее, чем 1 месяц; прогрессирование — увеличение размеров опухоли на 25% и больше либо появление новых очагов опухолевого поражения (44).
Недостатком данного метода, является то, что в случаях, леченных с частичным эффектом или со стабилизацией, отсутствует учёт биологической активности остающейся опухолевой ткани в момент контрольного обследования. Метод не позволяет определить (в большинстве случаев) начинающийся рост опухоли, улавливая его лишь при регистрации увеличения размера опухоли на 25% и больше. Понятно, что на это уходит время и, так же понятно, что это время оказывается упущенным для применения других, возможно, эффективных вариантов лечения. С другой стороны, важно иметь полноценную информацию в случаях, когда за опухоль принимается рубец, оставшийся на месте опухоли, для продолжения эффективного лечения или перехода к наблюдению, а не к изменению методов лечения.
На заре развития клинической радионуклидной диагностики было показано закономерное снижения накопления 32Р в опухоли в случаях эффективной терапии поверхностно расположенных опухолей (24, 34, 10). Интенсивность включения 32Р в опухоль обусловлена интенсивностью синтетических процессов в ней, косвенным образом уровень ОНРОп отражает скорость роста опухоли и
интенсивность пролиферации опухолевых клеток. Одной из причин ограниченного применения метода была трудность бета-радиометрии, связанная с небольшой длиной пробега бета-частиц, испускаемых 32Р в тканях (в среднем 3 мм). Разработка миниатюрных
полупроводниковых бета-детекторов, заключённых в игловидный корпус (3) решает эту проблему и позволяет проводить бета-радиометрию непосредственно в остаточном уплотнении.
Определение ОНРОп2 произведено 62 больным РМЖ после консервативной терапии. 30 больных с частичным эффектом или стабилизацией опухоли исключены из анализа в связи с произведенной операцией и невозможностью проследить дальнейшую динамику
размеров опухоли. Анализируются 32 больные РМЖ I — III стадий. Больные получали консервативное лечение (лучевое, химиотерапевтическое, эндокринное, комплексное) в различных вариантах в качестве предоперационного или самостоятельного лечения. У
всех больных был достигнут эффект, который первоначально оценивался как частичный или стабилизация (44). Этим больным производилось определение ОНРОп2, в последующем среди них уда-
лось выделить группы больных с полным эффектом и с прогрессированием опухоли. Выделение группы больных с полным эффектом основывалось на результатах гистологического исследования материала, полученного после модифицированной радикальной мастэктомии, произведённой не позднее 1 недели после определения ОНРОп2, или маммографии, произведённой не позднее 1 недели с дальнейшей прослеженностью на протяжении не менее 1 месяца. Ретроспективно, также на основании прослеженности динамики размеров опухоли в сроки не менее 1 месяца после определения
ОНРОп2, были сформированы группы больных, у которых наблюдались частичный эффект, стабилизация и прогрессирование опухоли.
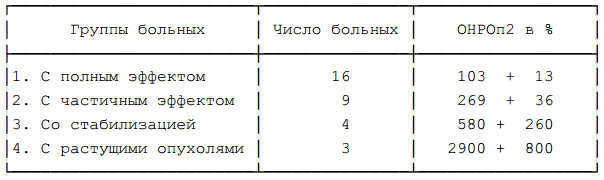
Средние величины ОНРОп2, определённого у всех 62 больных после лечения составили 486+81%, что значительно ниже средних величин ОНРОп1, — 1477+174% (различия статистически значимы, Р<0,01). Уровень ОНРОп2 в анализируемых группах больных (смотри таблицу 11) хорошо коррелировал с ретроспективно определённой оценкой эффекта: у больных с полным эффектом наблюда-
Таблица 11. Уровень ОНРОп2 у больных раком молочной железы с различным эффектом противоопухолевой терапии.
Примечание: различия не значимы при сравнении 2 группы с 3 группой, при сравнении всех других групп между собой различия статистически значимы, Р<0,01. лось низкое ОНРОп2 с уровнем включения 32Р в опухоль практически равным уровню включения 32Р в нормальную ткань, у больных с прогрессированием опухоли наблюдалось высокое ОНРОп2, превышающее накопление радионуклида в нормальной ткани в среднем в 29 раз. Наряду с этим наблюдались средние величины ОНРОп2 при истинных состояниях стабилизации и частичного эффекта.
Высокий уровень ОНРОп2 не наблюдался у больных 1 – 3 групп, низкий уровень ОНРОп2 наблюдался у 2 больных 2 группы (у одной из них полный эффект наступил через 1 месяц после определения ОНРОп2, у второй — через 3 месяца после определения ОНРОп2) и у 1 больной 3 группы (остаточное уплотнение в молочной железе продолжает оставаться стабильным более 6 месяцев).
Рассмотрим примеры.
Больная М.Н.Ю., 34 лет, история болезни N 88/3453. Диагноз: рак правой молочной железы T4N2M0. Диагноз подтверждён
при цитологическом исследовании пунктата из опухоли и по данным гистологического исследования биопсийного материала. Было проведено химиолучевое лечение, включавшее облучение молочной железы в СОД 68 Гр и химиотерапию по схеме CMF. Лечение сопровождалось уменьшением опухоли в размерах. В конце курса лечения проведено определение ОНРОп2 = 114%. Через 1 месяц была произведена радикальная мастэктомия с сохранением большой грудной мышцы. При гистологическом исследовании обнаружен выраженный патоморфоз, элементов опухоли в молочной железе не найдено.
Больная В.Е.Н., 64 лет, история болезни 85/14575. Диагноз: рак правой молочной железы T4N2M0. В январе – марте 1986г. больной было проведено консервативное лечение, включавшее лучевую терапию по радикальной программе и эндокринную терапию зитазониумом. Достигнут частичный эффект, продолжен приём зитазониума. 3.06.87 определено ОНРОп2 = 4383%. Диагностировано завершение эффекта лечения, проводилась химиотерапия по схеме CAM (циклофосфан, адриамицин, метотрексат). Однако химиотерапия была неэффективной, через 2 месяца констатировано увеличение первичной опухоли в два раза, ещё через 4 месяца выявлены метастазы в лёгких.
Определение эффективности проводимого консервативного противоопухолевого лечения является серьёзной проблемой, решение которой позволяет для каждого больного оптимизировать лечение за счёт отказа от неэффективных и применения эффективных средств.
Уровень ОНРОп2 может быть использован как дополнительный фактор оценки эффективности лечения, так например, высокий уровень ОНРОп2 означает наличие быстрорастущей опухоли и неэффективность лечения; при низком уровне ОНРОп2 можно говорить об отсутствии элементов опухоли в остаточном уплотнении и о
наличии полного эффекта (при соблюдении всех остальных позиций, характеризующих полный эффект, то есть при отсутствии других очагов поражения, кроме исследуемого). В данном случае уровень ОНРОп2, отражая интенсивность пролиферации опухолевых клеток, имеет прогностическое значение, так же, как это было показано при прогнозировании течения РМЖ с помощью определения
ОНРОп1.
Оценка эффективности лечения солидных опухолей, рекомендованная ВОЗ (44) и основанная на определении динамики размеров опухоли в случаях, леченных с частичным эффектом и со стабилизацией может быть дополнена определением ОНРОп2 в остаточной опухоли, что позволит своевременно выявить бурный рост
опухоли, означающий неэффективность лечения, констатировать полный эффект либо подтвердить состояние частичного эффекта или стабилизации.
8. Оценка операбельности рака молочной железы
III стадии
Правильное определение операбельности позволяет для каждого больного оптимизировать лечение за счёт отказа от операций, сопровождающихся быстрым местнорегионарным возвратом болезни, в пользу модификации и интенсификации консервативного
лечения. Как известно, понятие операбельности при РМЖ подразумевает не просто техническую возможность удаления опухоли, но возможность достижения с помощью операции стойкого местнорегионарного контроля болезни (28).
В настоящее время общепринято оценивать операбельность по клинической или клинико-рентгенологической динамике местных проявлений: уменьшению, увеличению или стабилизации первичной
опухоли, отёка кожи и метастазов в регионарных лимфатических узлах. В то же время может оказаться полезным для оценки операбельности больных РМЖ III стадии, прошедших предоперационное лечение с частичным эффектом или стабилизацией, определение интенсивности включения 32Р в опухоль.
ОНРОп2 после проведения предоперационной терапии определено у 31 больной РМЖ III стадии. Все больные имели частичный эффект или стабилизацию, были прооперированы и получали адъювантную системную терапию. В последующем больные прослежены,
процесс развития местно-регионарного рецидива оценён с помощью построения кривых выживаемости без местно-регионарного рецидива актуариальным методом в группах больных с разным уровнем ОНРОп2 (см. рисунок 2). Статистическая значимость различий определена с помощью подсчёта критерия Х2 (Mantel N., Haenszen W.).
Из рисунка 2 можно видеть, что у больных с относительно высоким уровнем ОНРОп2 вероятность быстрого развития местнорегионарного рецидива значительно выше, чем у больных с низким уровнем ОНРОп2, различия достоверны, P<0,02.
Примеры:
1. Больная К.М.И., история болезни 84/15458. Диагноз: РМЖ T4N2M0. В качестве предоперационного лечения был проведён курс комбинированной химиотерапии, получен частичный эффект. Определён уровень ОНРОп2 = 143%. Произведена радикальная мастэктомия с сохранением большой грудной мышцы. При гистологическом исследовании отмечено наличие умеренного патоморфоза в опухоли. Проводилась профилактическая химиотерапия. Отмечено безрецидивное течение в сроки более 2,5 лет.
2. Больная Т.Н.К., история болезни N 89/5572. Диагноз: РМЖ T4N1M0. Перед операцией была проведена лучевая терапия на молочную железу и зоны регионарного метастазирования в СОД 40 Гр. Лечение с частичным эффектом. Определён уровень ОНРОп2 =933%. Произведена радикальная мастэктомия с сохранением большой грудной мышцы. В дальнейшем проводилась профилактическая комбинированная химиотерапия. Через 1 год и 3 месяца наступил рецидив болезни с поражением кожи в зоне оперативного вмешательства, регионарных лимфатических узлов, лёгких и печени.
Принято оценивать операбельность РМЖ III стадии после предоперационного лечения по клиническим критериям, которые предполагают отсутствие признаков местного, регионарного и отдалённого прогрессирования болезни. Клиническим признаком операбельности признаётся уменьшение или полное исчезновение опухоли в молочной железе и метастазов в лимфатических узлах (6, 16, 38). Подобная оценка операбельности далеко не всегда оказывается достоверной, нередки случаи, когда в ближайшие годы после операции развивается местно-регионарный рецидив опухоли несмотря на отчётливое уменьшение опухоли в размерах после предоперационной терапии. Причиной этого, по-видимому, является гетерогенность опухолевых клеток, что позволяет, наряду с гибелью большей их части, сохранить клоны клеток, обладающих высоким потенциалом роста. Основной целью предоперационного
лечения является «девитализация» опухолевых клеток, что позволяет повысить радикализм операции. В то же время, методов оценки рецидивирующего потенциала остаточной опухоли или, иными словами, оценки степени «девитализации» не существует.
Надеюсь, что в какой-то степени этот пробел восполняет данная работа. У больных РМЖ III стадии, леченных с эффектом или со стабилизацией после предоперационного противоопухолевого лечения, низкий уровень ОНРОп2 позволяет констатировать операбельное состояние (риск развития местнорегионарного рецидива в ближайшие 2 года — 13%). Высокий уровень ОНРОп2 в остаточной опухоли позволяет выделить группу больных с высокой (68%) вероятностью быстрого развития местнорегионарного рецидива, то есть больных в неоперабельном состоянии.
9. Оценка безопасности метода
Ни в одном случае применения метода внутритканевой бета-радиометрии не наблюдалось каких-либо осложнений местного или общего характера.
В связи с потенциально возможным провоцированием ускоренного развития опухоли в результате внедрения в нее инородного тела, нами сравнены показатели безрецидивной выживаемости больных раком молочной железы III стадии, которым проводилось внутритканевое исследование, с аналогичными показателями общего массива больных, лечившихся в то же время теми же методами с той же исходной степенью распространенности опухоли. Так, двухлетняя безрецидивная выживаемость всех 244 больных РМЖ T3-4N2-3M0 составила 64,5+3,5%, в том числе больных, которым производилась инвазивная бета-радиометрия (20 больных) — 67,0+11,2%; всех 334 больных РМЖ T1-2N2-3M0 и T3-4N0-1M0 — 85,2+2,1%, в том числе больных, которым производилась инвазивная бета-радиометрия (17 больных) — 84,5+10,5%. Различий безрецидивной выживаемости в зависимости от применения внутритканевой бета-радиометрии не наблюдается, что позволяет характеризовать методику как безопасную.
10. Заключение
Прошло 45 лет после первого применения 32Р для диагностики РМЖ. Метод пережил период всеобщего увлечения и в настоящее время, по ряду причин, предан заслуженному забвению. Это связано, прежде всего, с радиогигиеническими проблемами, возникающими при использовании 32Р, из которых основной является отсутствие туморотропности радионуклида; с наличием эффективных конкурирующих методов диагностики РМЖ, таких, как маммография, цитологическое исследование, ультразвуковая томография; а также с трудностями бета-радиометрии, обусловленными небольшим (в среднем — 3 мм) пробегом в тканях бета-частиц, испускаемых 32Р.
Проявления радиотоксичности 32Р в случаях его применения в терапевтических ВР (при истинной полицитемии, канцероматозе брюшины при раке яичников, диссеминированном РМЖ) состоят в лейкопении, тромбоцитопении, анемии и этим близки к большинству используемых противоопухолевых химиотерапевтических лекарств. Так же, как и цитостатики, 32Р канцерогенен, что было показано в эксперименте на животных. Эти свойства 32Р также существенно ограничивают его использование для нужд диагностики опухолей, в том числе и РМЖ, так как такая процедура подразумевает возможность облучения не только онкологических больных, но и здоровых лиц.
На мой взгляд, применение 32Р возможно только у больных с доказанным диагнозом рака, этот радионуклид не должен использоваться для диагностики опухолей. Важной особенностью фармакокинетики 32Р является его включение в синтез нуклеиновых кислот, белков, фосфолипидов, энергетический обмен. С некоторой степенью приближения можно сказать, что интенсивность захвата 32Р опухолью отражает интенсивность пролиферации опухолевых клеток. Возможность одномоментной оценки интенсивности пролиферативных процессов в опухоли является привлекательной
стороной радиофосфорного исследования, его применение оказывается полезным для прогнозирования скорости развития отдалённых метастазов, оценки операбельности РМЖ III стадии, оценки эффективности противоопухолевого консервативного лечения.
Перспективно изучение возможности прогнозирования течения РМЖ T1-2N0M0, поскольку при такой степени распространённости РМЖ применение адъювантной системной терапии дискутабельно, а использование надёжных факторов прогноза может позволить дифференцированно подойти к назначению адъювантного лечения.
S U M M A R Y
Breast cancer: the possibilities of the intratissual radiophosphorus examination in diagnostic, prognose and management of treatment.
The paper concerns the working out of the method of intratissual radiophosphorus examination in the cases of
— 44 —
breast cancer and the evaluation of possibility of application of the method in oncological practice.
There were analised 148 patients with breast cancer, 2 patients with sarcoma of the breast and 8 patients with benign diseases of the breast. Detection of the relative uptake of the 32P (RU 32P) was performed by semiconductor beta-detector, accorded by the Physico-Technical Institute by the name of A.F.Ioffe of the Academy of Science of the
USSR.
The important advantage of the intratissual
beta-radiometry, and in particular , of intratumoral placement of the beta-detector, is the rising efficiency of the count.
For example, the RU 32P to breast cancer performed by beta-detector on the tumor surface was 198+27%, and in cases of the intratumoral placement of the beta-detector RU 32P was much higher — 1475+174%. This difference may be easy explained
taking into account, that average length of the trace of beta-particle from the 32P in tissue is about 2-4 mm.
It’s known that in tumoral tissue a phosphour is included in synthesis of nucleic acids, proteins, phospholipids, playing the role of «building material« for the new appearing tumor cells. The intencity of the uptake of 32P into tumor tissue reflects the intencity of tumor growing and gives possibility to measure it immediately.
Evaluation of the RU 32P into tumor in different clinical situations allows:
1. To help in prognosing speed of the developing of the metastases, when it’s measuring initial level. For example, there are demonstrated possibility to separate the brest cancer stage III patients in group with high probability of quick relapse of disease (two-years diseas-free survival 55,1+12,1%) and group with relative good course of the disease with two-years diseas-free survival equal 94,1+5,7%.
2. To raise reliability of the evaluation of efficiency of any antitumoral conservative treatment in patients treated with part effect and with stabilisation. In this group of patients the method allows to identify cases with quick
growth of tumor and cases equal for complete remission.
3. To raise reliability of the evaluation of the operability breast cancer stage III patients after conservative antitumoral treatment. Among the patients with part effect and with stabilisation the evaluation of RU 32P into tumor identifies patients with high risk of quick
locoregional relapse. These patients need modification and intensification of conservative treatment, because after operation (modified radical mastectomy by Patey) they have two-years survival without locoregional relapse only 32,2+17,7%. The patients identified as operable have two-years survival without locoregional relapce 86,8+8,8%.
There was also analised the possibility of the intratissual radiophosphorus examination in the field of traditional use of 32P — diagnosis of cancer, it`s clear, that method is not perspective for its low specificity, although its sensitivity are quite high.
There were data that may convince in the safety of the intratissual radiophosphorous examination. We have not seen any local or common complications. Application of the method does not influence the disease-free survival of the patients.
Источники литературы
1. Агранат В.З. Радиоизотопная диагностика злокачественных опухолей. «Медицина», М., 228 с.
2. Акимочкина З.Е. — Опыт применения радиоактивного фосфора (Р32) для диагностики поверхностно расположенных опухолей и опухолевидных образований. Автореф. дисс. … к.м.н. М., 1961.
3. Афанасьева Н.Н., Ерёмин В.К., Строкан Н.Б., Тархин Д.В. — Полупроводниковые детекторы для внутриполостной и внутритканевой радиофосфорной диагностики рака. — «Медицинская радиология», 1983, N9, 62-64.
4. Гродзенский Д., Ильина Л. — Исследование фосфорного обмена при физиологических и патологических условиях с помощью радиоактивного фосфора. — Физиологический журнал СССР имени И.М.Сеченова, 1940, 29, 4, 341-344.
6. Дымарский Л.Ю., «Рак молочной железы», М., 1980, 200c.
7. Зубовский Г.А., Габуния Р.И. — Основы радионуклидной диагностики. В: Клиническая рентгенорадиология., Москва, Медицина, 1985, т.4, 6 — 59.
8. Криштафович А.А. Комплексная рентгенорадионуклидная диагностика рака лёгкого. Автореф. дисс…. д.м.н., Л.,1983.
9. Крылова М.О. Редкие формы рака молочной железы (Клинико-морфологические особенности и факторы прогноза). — Автореф. дисс. …к.м.н., Москва, 1989.
10. Маклецова Н.П. Применение радиоактивного фосфора (Р32) с диагностической и терапевтической целью. Автореф. дисс. … к.м.н. Л., 1961.
11. Меленчук И.П. Применение Р32 для диагностики заболеваний молочной железы. Мед. радиология, 1964, 8, 81-87.
12. Непесов А.К.,»Клиническая оценка распространённости рака молочной железы.», Автореферат дисс. … к.м.н., М.,1985.
13. Поддубный Б.К., Габуния Р.И.,Уншадзе Г.В., Нургужаев К.С. Результаты комплексной бронхофиброскопической и радиометрической диагностики рака лёгкого.- Мед.радиология, 1982, 27, 7, 89-90.
14. Поддубный Б.К., Кувшинов Ю.П., Шишков А.С., Мазуров С.Т., Любарский В.И.- Фиброгастроскопия, лапароскопия и эндоскопическая радиометрия в уточнённой диагностике эндофитной формы рака желудка.- Зравоохранение, Кишинёв, 1983, N2, 45-46.
15. Поддубный Б.К., Кныш В.И., Веселов В.В., Ожиганов Е.Л., Шабаров В.Л. — Сочетанная колоноскопическая и радиометрическая диагностика рецидивов рака толстой кишки.- Клиническая медицина, 1984, 62, N7, 90-92.
16. И.Г.Соколова. Предоперационная полихимиотерапия в комплексном лечении местно распространённого рака молочной железы», Дисс. на соиск. уч. степ. к.м.н., М., 1983, 143 стр.
17. Уманский Ю.А. — О накоплении искусственно-радиоактивного фосфора в опухолях. — Автореферат дисс. … к.м.н., Киев, 1951.
18. Шевченко И.Т., Значковский Н.Г., Городыский В.И., Весёлая И.В. — О применении радиоактивного фосфора для диагностики рака молочной железы. — Вестник рентгенологии и радиологии, 1954, 4, 49-53.
19. Albaum H., Goldfeder A., Eisler L. – Incorporation and Turnover of Radiophosphorus in Mouse Mammary Tumors (dbrB and C3H).- Cancer Res., 1952, 12, 3, 188-191.
20. Baak J.P., Von Dop H., Kuaver P.H., et al. – The value of morphometry to classic prognosticators in breast cancer. — Cancer, 1985, 56, 374 — 382.
21. Barnum C.R., Huseby R.A., Vermund H. — A time study of the incorporation of radiophosphorus into the nucleic acids and other compounds of a transplanted mouse mammary carcinoma. — Cancer research, 1953, 13,12,880-889.
22. Clark G.M., Dressler L.G., Owens M.A., et al. — Prediction of relapse of survival in patients with node-negative breast cancer by DNA flow cytometry. — N. Engl. J. Med., 1989, 320, 627-633.
23. Das Gupta N.N., Bhattacharya K.L., D.Choudhuri, et al. — The uptake of radioactive phosphorus in normal breast and breast tumors. — Acta radiol. (Stockh.), 1956, 45, 69-76.
24. Ellis F., Hoch-Ligeti C., Oliver R. — Investigation of the effect of x-radiation on the localization of radioactive phosphorus in breast tumors. British J. Cancer, 1951, 5, 1, 45-53.
25. Espinal E.G., Ubios A.M., Cabrini R.L. – Salivary gland tumors inducede by 32P. — J. Oral Pathol., 1984, 13,6,686 — 691.
26. Gershon-Cohen J., Berger S.M., Klikstein H.S. — Roentgenograpgy of breast cancer moderating concept of «biological predeterminism». Cancer — 1963, 16, 8, p.961-964.
27. McGuire W.L., Tandona K., Allred C. et al. — How to use prognostic factors in axillary node-negative breast cancer patients. — J.Nat. Cancer Inst.,1990, 82, 1001-1015.
28. Haagensen C.,Stout A. — Carcinoma of the breast: criteria of operabiliti. — Ann. Surg., 1943, 118, 1032-1052.
29. Holt S., Croton R., Leinster S.J., et al.- In vitro thymidin labelling index in primary operable breast cancer. Eur.J. Surg. Oncol., 1986, 12, 1,53-57.
30. Jones H.B., Chaikoff I.L., Lawrence J.H. – Phosphorus metabolism of neoplastic tissues (mammary carcinoma, lymphoma, lymphosarcoma) as indicated by radioactive phosphorus. — Amer. J. of Cancer, 1940, 40, 2, 243-250.
31. Kaplan E. Historical Development of 32P in bone therapy. In: Therapy in Nuclear medicine. N.Y., 1978, 237-249.
32. Kuroishi T., Tominaga S., Morimoto T., et al. – Tumor Growth Rate and Prognosis of Breast Cancer Mainly Detected by Mass Screening. — Jpn. J. Cancer Res., 1990, 81, 5, 454-462.
33. Low-Beer B.V.A., Bell H.G., McCorcle H.J. et al., — Measurement of Radioactive Phosphorus in Breast Tumors in situ: a Possible Diagnostic Procedure. Preliminary Report. — Radiology, 1946, 47, 492-493.
34. Low-Beer V.A., Green R.B.- Radiophosphorus studies in breast tumors. Six years` investigation of the validity of the surface measurement method.- Cardiologia, 1952, 21, 4/5, 497-505.
35. Meyer J.S., Friedman E., McCrate M.M., Bauer W. — Prediction of early course of breast carcinoma by thymidine labeling. — Cancer, 1983, 51, 10, 1879 — 1886.
36. Meyer J.S., Province M. Proliferative index of breast carcinoma by thymidine labelling: prognostic power independent of stage, estrogen and progesterone receptors. Breast Cancer Res. Treat., 1988, 12, 191-204.
37. Onsrud M., Bosnes V., Grahu J., Engenest A. – Changes in lymphoid cell distribution after intraperitoneal administration of 32P colloids. — Acta Radiol. Ser. Oncol., 1985, 24,4, 331-335.
38. Piccart M.J., de Valeriola D., Paridaens R. et al.- Six-Year Results of a Multimodality Treatment Strategy for Locally Advanced Breast Cancer., «Cancer», 62:2501-2506, 1988.
39. Reinhardt H., Stula D., Gratzl O. — Topographic studies with 32P tumor Marker during Operations of Brain Tumors. — Eur. Surg. Res., 1985, 17, 333-340.
40. Sigurdsson H., Baldetorp B., Borg A. et al. — Indicators of prognosis in node-negative breast cancer. N. Engl. J. Med., 1990, 322, 1045-1053.
41. Silvestrini R., Daidone M.G., Valagussa P. et al. — 3H-thymidine-labelling index as a prognostic indicator in node-positive breast cancer.- J. Clin. Oncol., 1990, 8, 1321-1326.
42. Spencer R.P. — Nuclear medicine: Focus on clinical diagnosis.- N.Y., 1977, 249p.
43. Wasserman J., Blomgren H., Petrini B. et al.- Changes of the blood lymphocyte subpopulations and their functions following 131I treatment for nodular goitre and 32P treatment for polycythemia vera. — Int.J.Radiat.Biol., 1988, 53, 1, 159-167.
44. WHO handbook for reporting results of cancer treatment. — World Health Organisation, Geneva, 1979.