12.1. Литературная справка
Исполнилось более 100 лет с момента описания W.S. Halsted радикальной мастэктомии, носящей его имя (128). Наиболее подробное описание техники операции дал С. Haagensen (126). Операция даёт надёжные результаты, в течение 40-х — 80-х годов она использовалась в качестве стандарта для сравнения с вновь разрабатываемыми операциями. К её недостаткам относят грубую деформацию грудной стенки, наносящую дополнительную психологическую травму больным. В настоящее время показаниями к радикальной мастэктомии по Halsted остаются прорастание первичной опухолью большой грудной мышцы и поражение лимфатических узлов Rotter`a, возможно также применение операции у больных РМЖ III стадии в случае неэффективного предоперационного лечения (193).
Patey and Disson в 1948 г. предложили модифицированную радикальную мастэктомию, отличающуюся от операции Halsted сохранением большой грудной мышцы (197). Несколько исследований, сравнивавших эффективность двух вариантов радикальной мастэктомии, продемонстрировали одинаковые результаты по БРВ и ОВ в сравниваемых группах (239, 171, 4). Однако, в одном из исследований, при выделении групп больных, имевших РМЖ III или II b стадий, было показано статистически значимое преимущество в 10-летней выживаемости больных, оперированных в объёме радикальной мастэктомии по Halsted (171).
Cледующий вариант модифицированной радикальной мастэктомии H. Auchincloss (1963) предусматривал сохранение обеих грудных мышц и ограничение объёма лимфаденэктомии: удалялась клетчатка латеральнее латерального края малой грудной мышцы (то есть только I уровня по Berg, 59). Модификация радикальной мастэктомии по Madden предусматривает сохранение обеих грудных мышц и удаление клетчатки I и II уровней по Berg (169, 170).
В 1976 г. В.В.Вишнякова опубликовала (10) описание радикальной резекции — органосохраняющей операции, применявшейся при латеральных локализациях небольших (до 3 см) опухолей. Операция состояла в клиновидном иссечении 1/3 — 1/4 объёма молочной железы, включающего опухоль, единым блоком с кожей, фасцией большой грудной мышцы и клетчаткой I — III уровней по Berg.
В 1985 г. были подведены результаты кооперированного исследования стран-членов СЭВ по оценке хирургического лечения РМЖ T1-2N0-1M0 у 816 больных. 230 больным производилась радикальная мастэктомия по Halsted (1-я группа), 318 больным 2-й группы — модифицированная радикальная мастэктомия по Patey, 218 больным 3-й группы — радикальная резекция. Исследование не было рандомизированным, состав групп больных был неоднороден, РМЖ I стадии наблюдался у больных 1-й группы в 37%, 2-й группы — в 48%, 3-й группы — в 72%. Дополнительное лечение не получали 73% больных 1-й группы, 85% больных 2-й группы и 53 % больных 3-й группы. Местный рецидив развился у больных 1-й группы — в 2,6%, 2-й группы — в 3,7% и 3-й группы — в 9,1%. 7-летние показатели БРВ и ОВ между сравниваемыми группами не различались статистически значимо (246).
С 1973 г. в Милане, в Национальном институте по лечению рака, проводилось рандомизированное исследование, в которое включались больные с размером первичной опухоли до 2 см и с отсутствием пальпируемых подмышечных метастазов. 349 больным была выполнена радикальная мастэктомия по Halsted (1-я группа), 352 больным была выполнена квадрантэктомия с послеоперационным облучением. Под квадрантэктомией подразумевалось: иссечение опухоли с запасом 2-3 см здоровой ткани молочной железы с подлежащей фасцией и кожей, а также подмышечная лимфаденэктомия всех трёх уровней. Если опухоль локализовалась в верхненаружном квадранте, удаление опухоли и лимфаденэктомия производились единым блоком. Не наблюдалось статистически значимых различий между группами больных по результатам БРВ и ОВ (241).
Наконец, самая маленькая по объёму удаляемой ткани молочной железы операция — лампэктомия (lump — глыба, кусок, комок), была разработана в ходе исследований Национального проекта дополнения операций на молочной железе и кишечнике (США, NSABBP). Операция состояла из двух компонентов: удаления опухоли и лимфаденэктомии, которые выполнялись из двух отдельных разрезов. Собственно удаление опухоли производилось через дугообразный кожный разрез, ориентированный по кожным складкам, удаление кожи и подлежащей фасции было не обязательным, запас здоровых тканей железы не регламентировался. Лимфаденэктомия производилась через кожный разрез, пересекающий подмышечную область в горизонтальном направлении. В исследование включались больные с опухолями не более 4 см. Сравнивались группы больных с различным лечением: 1) лампэктомия, 2) лампэктомия + лучевая терапия, 3) модифицированная радикальная мастэктомия. При поражении лимфатических узлов проводилась адъювантная химиотерапия. При 5-летнем наблюдении местный рецидив в молочной железе развился у больных 1-й группы в 28%, у больных 2-й группы -в 8%. 5-летние БРВ и ОВ в группе 1-й составили 63% и 85%, во 2-й группе — 72% и 85%, в 3-й группе — 66% и 76%. (103). 12-летние результаты подтвердили основной вывод: не было достоверных различий по показателям ОВ и выживаемости без отдалённых метастазов между сравниваемыми группами. За 12 лет местный рецидив в молочной железе после лампэктомии развился у 35% больных, после лампэктомии с облучением — у 10% больных (106).
Рандомизированное сравнение двух операций, лампэктомии и квадрантэктомии было проведено Veronesi U. с соавт. (242). В исследование включались больные с максимальным размером опухоли до 2,5 см, всего 705 больных. Всем больным проводилось послеоперационное облучение. Оказалось, что развитие отдалённых метастазов и выживаемость больных в группах идентичны, но у больных, перенесших лампэктомию, местный рецидив развивался достоверно чаще, чем у больных, оперированных в объёме квадрантэктомии, 7,0% против 2,2% соответственно.
Наибольший материал включён во вторичный анализ, проводимый Объединённой группой исследователей раннего рака молочной железы (Early Breast Cancer Trialists’ Collaborative Group). В базу данных включаются сведения о больных, вошедших в рандомизированные исследования, проводимые по РМЖ во всём мире. Последний анализ включает сравнение 2468 больных, перенесших органосохраняющие операции, с 2423 больными, перенесшими радикальные мастэктомии (91). По его результатам ОВ и выживаемость без отдалённых метастазов в сравниваемых группах идентичны.
U.Veronesi с соавт., 1995 (244), анализируя результаты лечения 1973 больных с медианой прослеженности 82 месяца, пришли к выводу, что при размере опухоли до 2,0 — 2,5 см вполне возможно проведение органосохраняющего лечения. В группах больных, оперированных в объёме радикальной мастэктомии по Halsted, квадрантэктомии с лучевой терапией, лампэктомии с лучевой терапии, квадрантэктомии без облучения показатели ОВ не разнятся между собой. Частота развития местных рецидивов после лампэктомии с лучевой терапией и после квадрантэктомии без облучения были значительно чаще, чем после радикальной мастэктомии и после квадрантэктомии с лучевой терапией.
По данным Holland P.A., с соавт., 1995 (133), проведение органосохраняющего лечения у больных РМЖ с дольковым инвазивным раком не сопровождается повышением риска рецидива рака в молочной железе по сравнению с аналогичным лечением больных протоковым инвазивным раком.
Высокая частота местного рецидива в молочной железе после органосохраняющих операций с послеоперационным облучением характерна для больных моложе 35-40 лет. По данным J.M.Kurtz с соавт. (155) в возрастной группе до 40 лет местный рецидив развился за 5-летний период в 19% случаев, а в возрасте старше 40 лет — в 9%. B.L. Fowble с соавт., 1994 (110), у больных в возрасте до 35 лет наблюдали развитие местного рецидива в 40 %, в возрасте 36 — 50 лет — в 16% и в возрасте старше 50 лет — в 13% случаев при средней длительности наблюдений 4,6 года. Neff P. Т. с соавт., 1996,при медиане прослеженности 5 лет наблюдали развитие местного рецидива в возрасте до 40 лет в 24% случаев, старше 40 лет — в 6 % случаев (185).
По нашим данным проведение органосохраняющих операций в сочетании с лучевой терапией не сопровождалось повышением частоты местных рецидивов в сравнении с модифицированной радикальной мастэктомией (41, 26, 43).
Guenther J.M., et al., 1996, подробно описывают тактику оперативного лечения больных РМЖ с Т1-Т2 в возрасте до 35 лет, у которых лечение началось с секторальной резекции молочной железы с подмышечной лимфаденэктомией. У них в 54% случаев при микроскопии были обнаружены признаки инвазии краёв иссечённого сектора, что послужило поводом для повторного иссечения резецированного края (8%) и мастэктомии (23%). Ещё 13% больных от их общего числа отсроченная мастэктомия была выполнена по поводу местного рецидива. В целом, для больных в возрасте до 35 лет выполнение мастэктомии оказалось необходимым в 50% случаев, для больных старше 35 лет — в 21% случаев (118).
При анализе результатов органосохраняющих операций неизбежно встаёт очень важный вопрос: неужели действительно развитие местного рецидива в молочной железе не приводит к повышению риска диссеминации болезни и ухудшению выживаемости, как это бывает после радикальной мастэктомии (57)?
Vishnyakova V.V., с соавт., 1986 (246); U.Veronesi с соавт., 1995 (244); Fisher B с соавт. 1995 (106); Объединённая группа исследователей раннего рака молочной железы, 1995 (91), не находили такого ухудшения, при возникновении рецидива своевременно выполненная мастэктомия (salvage mastectomy) или удаление рецидива с повторным облучением действительно имели спасительное значение для большинства больных. В итоге, при сравнении больших групп больных, исходно получавших различное местное лечение, влияние появления местного рецидива на выживаемость нивелировалось.
Проведение многофакторного анализа, при котором помимо обычно анализируемых факторов учитывается факт развития местного рецидива в молочной железе, показывает достоверное ухудшение выживаемости больных, имевших местный рецидив (250, 162).
Вопрос о назначении адъювантной системной терапии больным первично операбельным РМЖ принято разбивать на две части. Часть первая состоит в определении, нуждается ли больная в адъювантном лечении вообще. При положительном ответе возникает вторая часть вопроса, включающая выбор метода лечения. Для больных первично иноперабельным РМЖ, переведённым в операбельное состояние и прооперированным, первая часть вопроса всегда решается положительно.
По консенсусному решению Международной конференции по адъювантной терапии рака молочной железы, принятому в 1990 г. адъювантная системная терапия при инфильтративном РМЖ считается не показанной при отсутсвии поражения регионарных лимфатических узлов, размере опухоли до 1,0 см включительно (T1a-T1bN0M0) и I степени злокачественности опухоли, за исключением случаев, когда присутствуют другие неблагоприятные факторы прогноза(147). Всем остальным больным показана адъювантная системная терапия. Интересно, что за 5 лет до этого решения, показания к проведению адъювантной терапии ставились значительно уже: больным репродуктивного периода с поражением лимфатических узлов рекомендовалось проведение адъювантной химиотерапии, больным в менопаузе с поражением лимфатических узлов и РЭ+ опухолями рекомендовалось проведение адъювантной эндокринной терапии тамоксифеном; всем больным без поражения лимфатических узлов и больным в менопаузе с поражением лимфатических узлов и РЭ- опухолями проведение адъювантной терапии не рекомендовалось (80).
Выбор адъювантной терапии основан на учёте, прежде всего, репродуктивного статуса больной и уровня РЭ. У больных репродуктивного периода химиотерапия более эффективна, чем у больных, находящихся в менопаузе. При РЭ- опухолях шансы на эффективное эндокринное лечение низки, больным предлагается химиотерапия. Больным с РЭ+ опухолями возможно проведение эндокринной терапии.
Из методов адъювантной терапии первым стало изучаться применение удаление яичников или лучевое подавление их функции. Ранние работы, при которых включались в рандомизацию относительно небольшое количество больных РМЖ различных стадий, констатировали отсутствие улучшения БРВ и ОВ в опытной группе больных (196, 187, 210). Эффект от этой процедуры проявился в значительно более поздние сроки и стал очевиден при вторичном анализе объединённых массивов больных, первые группы которых лечились в 1948 — 1950 гг. (90, 92). Была убедительно показана эффективность удаления яичников или лучевого подавления их функции у больных в возрасте до 50 лет как с поражёнными лимфатическими узлами, так и с отсутствием такого поражения. Снижение риска рецидива болезни составила 26+/-6%, а снижение риска смерти — 25+/- 7% вне зависимости от уровня РЭ.
Среди лекарственных средств адъювантной эндокринной терапии наиболее популярно применение тамоксифена, показавшего у больных диссеминированным РМЖ столь же высокую эффективность, как препараты медроксипрогестерона ацетата и блокаторы бета-ароматазы, в сочетании с низкой частотой побочных эффектов. При длительном применении побочные эффекты наблюдаются в 2 (219) — 3,5% (46).
Двухлетнее профилактическое лечение тамоксифеном (20 мг в сутки) при медиане прослеженности 66 месяцев снижало риск рецидива болезни на 36% и смерти на 29% (без учёта уровней РЭ, репродуктивного статуса и поражения лимфатических узлов); был поставлен вопрос о целесообразности изучения более длительного приёма препарата (189). Приём тамоксифена на протяжении 2 лет статистически значимо повышал показатели БРВ и ОВ (71). Ряд других рандомизированных исследований, выполнявшихся в те же годы, не смог продемонстрировать столь очевидного успеха.
Более поздние публикации подтвердили высокую эффективность адъювантного применения тамоксифена, большое количество рандомизированных исследований вошли во вторичный анализ, проведённый Объединённой группой исследователей раннего рака молочной железы (Early Breast Cancer Trialists’ Collaborative Group) в 1992г. В анализ было включено 30000 рандомизированных больных, прослеженных не менее 10 лет. В целом применение тамоксифена снижало риск возврата болезни на 25+/-2%, риск смерти — на 17+/-2%. При сравнении показателей выживаемости суммировались, с одной стороны, — все группы больных, получавших тамоксифен и тамоксифен + химиотерапию, с другой стороны — все группы контроля, не получавшие никакого лечения или получавшие химиотерапию (90).
Снижение риска рецидива болезни при приёме тамоксифена на протяжении 1 года составило 16+/-3%, при приёме тамоксифена на протяжении 2 лет — 27+/-2%, при приёме тамоксифена на протяжении 3-5 лет — 38+/-4%; снижение риска смерти составило 11+/-4%, 18+/-3% и 24+/-6% соответственно. У больных репродуктивного периода риск рецидива болезни снижался на 12+/-4% (<50 лет) и 33+/-7% (>50 лет), у больных, находящихся в менопаузе, риск рецидива болезни снижался на 12+/-15% (<50 лет), 28+/-3% (50-59 лет), 29+/-3% (60-69 лет) и 28+/-5% (70 лет и старше). Риск смерти больных репродуктивного периода снижался на 6+/-5% (<50 лет) и 23+/-9% (>50 лет), у больных, находящихся в менопаузе, риск смерти снижался на 19+/-4 % (50-59 лет), 17+/-4 % (60-69 лет) и 21+/-6 % (70 лет и старше).
По мнению Baum M., 1995, адъювантная эндокринная терапия доказала свою эффективность как у больных в менопаузе, так и у больных репродуктивного периода. Текущими вопросами, подлежащими разрешению, являются: у больных в менопаузе — уточнение оптимальной длительности применения тамоксифена, у больных репродуктивного периода — проблема сочетания химиотерапии с эндокринной терапией (72).
Опыт адъювантного применения тамоксифена более 5 лет пока невелик и не оптимистичен, в частности Stewart H.J. с соавт., 1996, не наблюдали очевидного усиления эффекта, в то же время риск развития рака эндометрия возрастал (232).
Проведение рандомизированных исследований по адъювантной химиотерапии РМЖ имеет меньшую по длительности историю, но по количеству публикаций, превосходит исследования по адъювантной эндокринной терапии. Первые исследования включали изучение эффективности коротких периоперационных курсов монохимиотерапии.
B.Fisher с соавт., 1975, исследование NSABP-01, набор больных РМЖ II стадии производился в 1958 -1961 гг. У больных после радикальной мастэктомии изучалось влияние короткого курса химиотерапии тиофосфамидом на БРВ и ОВ. По 5- и 10- летним показателям статистически значимых различий не было обнаружено (102).
R.Nissen-Meier с соавт., 1978, в исследование было включено 1136 больных РМЖ I-II стадий, половине из них после радикальной мастэктомии проводился 6-дневный курс химиотерапии циклофосфаном. Получено достоверное повышение показателей БРВ и ОВ. После 14 лет наблюдений превышение ОВ в группе больных, получавших химиотерапию, над контрольной группой составило 13% (188).
За короткими одиночными курсами химиотерапии последовали курсы длительного лечения. G.Bonadonna с соавт., применяя разработанную ими схему химиотерапии CMF в качестве адъювантного средства (проводилось 12 курсов лечения, исследование Милан 1 началось в 1973г.) добились достоверного повышения показателей БРВ и ОВ у больных репродуктивного периода с поражением регионарных лимфатических узлов. У больных, находящихся в менопаузе, наблюдалось достоверное улучшение показателей только БРВ (76).
Сходные результаты были получены B.Fisher с соавт., 1986. Применение L-фенилаланина мустарда (сарколизина) в течение 5 дней каждые 6 недель на протяжении 2 лет привело к статистически значимому улучшению 10-летней БРВ и ОВ у больных репродуктивного периода. У больных, находящихся в менопаузе статистически значимый различий показателей БРВ и ОВ получено не было (105).
Серьёзный вклад в оценку влияния адъювантной химиотерапии на течение РМЖ внёс вторичный анализ, проведённый Объединённой группой исследователей раннего рака молочной железы (Early Breast Cancer Trialists’ Collaborative Group) в 1992г. В анализ было включено 18000 рандомизированных больных, в целом полихимиотерапия снижала риск развития рецидива болезни на 28+/-3%, а риск смерти — на 16+/-3%. В частности, у больных с сохранённым менструальным циклом риск рецидива болезни снижался на 36+/-5% (<50 лет) и 25+/-9% (>50 лет), у больных, находящихся в менопаузе, риск рецидива болезни снижался на 37+/-19% (<50 лет), 29 +/-5% (50-59 лет), 20+/-5% (60-69 лет). Риск смерти больных репродуктивного периода снижался на 25+/-6% (<50 лет) и 23+/-9% (>50 лет), у больных, находящихся в менопаузе, риск смерти снижался на 13+/-7 % (50-59 лет), 10+/-6 % (60-69 лет).
Проведение химиотерапии по схеме СMF приводило к снижению риска рецидива на 32+/-4%, химиотерапии по схеме CMF с добавлением какого-либо препарата (доксорубицин или винкристин или препараты платины) — на 23+/-6%. Риск смерти при этих сравнениях снижался на 22+/-5% и на 10+/-7% соответственно.
Сравнение курсов полихимиотерапии с курсами монохимиотерапии показало преимущество первого вида лечения над вторым по показателю уменьшения риска рецидива (на 12+/-5%) и смерти (17+/-5%). При сравнении большего числа крусов полихимиотерапии с меньшим числом курсов по той же схеме (7 АС против 3-5 АС; 12 CMF против 6 CMF и так далее) не обнаружено преимуществ большего числа курсов перед меньшим (90).
G.Bonadonna & P.Valagussa (75) анализировали ретроспективно суммарную дозу препаратов, получаемых больными за весь период адъювантной химиотерапии по схеме CMF в ходе исследования Милан 1. Больные, получавшие лечение, были разбиты на 3 группы в зависимости от соотношения полученных доз препаратов к расчётным дозам: <65 %, 65 — 84% и >=85% . Среди больных репродуктивного периода только 22% больных получили дозы препаратов>=85%, а среди больных, находящихся в менопаузе — только 11%. 10-летняя БРВ больных, получивших>=85% от расчётной дозы, составила 56%, а больных, получивших < 65 % от расчётной дозы, — 39% (р=0,0006). 10-летняя ОВ составила 66% и 47% соответственно (р=0,04).
Hryniuk W. & Levine M.N. (137) провели вторичный анализ серии опубликованных исследований и установили, что существует прямая корреляция между интенсивностью дозы вводимых химиопрепаратов и показателями выживаемости больных. Интенсивность дозы вычислялась в мг/м2 за неделю для каждого препарата и каждого больного как частное от деления суммарной дозы препарата на площадь поверхности тела больного и на время проведения всех курсов химиотерапии в неделях.
12.2. Сравнение операций.
Нами анализируются 5 операций, пользовавшихся в ОНЦ в разные годы различной популярностью. Радикальная мастэктомия по Halsted была самой частой операцией до 1980 — 1982 гг., затем её сменили радикальная мастэктомия с сохранением большой грудной мышцы (модифицированная радикальная мастэктомия по Patey) и радикальная мастэктомия с сохранением обеих грудных мышц (модифицированная радикальная мастэктомия по Madden). Особенностью выполнения последней операции в ОНЦ было то, что регионарная клетчатка удалялась полностью, то есть 1-го, 2-го и 3-го уровней по Berg (подключичной, подмышечной и подлопаточной областей). Такая модификация операции Madden полностью приближает её к операции Patey и лишает смысла их дифференцированный анализ.
Радикальная мастэктомия по Halsted была выполнена 110 больным, радикальная мастэктомия с сохранением большой грудной мышцы (модифицированная радикальная мастэктомия по Patey) или с сохранением обеих грудных мышц (модифицированная радикальная мастэктомия по Madden) были выполнены 1299 больным. Соотношение степени распространённости болезни с видом радикальной мастэктомии (РМЭ) представлено в сравниваемых группах на графиках 12.1 — 12.6.
В середине 70-х годов в ОНЦ (в те годы — Институт экспериментальной и клинической онкологии АМН СССР) В.В.Вишняковой была разработана радикальная резекция (РР) молочной железы — органосохраняющая операция, применявшаяся при латеральных локализациях небольших (до 3см) опухолей (10). Операция включала удаление 1/3 — 1/4 объёма молочной железы единым блоком с регионарной клетчаткой подключичной, подмышечной и подлопаточной областей (1-го, 2-го и 3-го уровней по Berg). В последующие годы популярность радикальной резекции нарастает, она широко применяется в самостоятельном варианте или в сочетании с лучевой терапией.
В последние 9-10 лет применяется органосохраняющая операция меньшего объёма чем радикальная резекция — секторальная резекция молочной железы с подмышечной лимфаденэктомией (СРЛЭ), имеющая прототипом так называемую “лампэктомию”, разработанную в рамках исследования Национального проекта по адъювантному лечению операций на молочной железе и толстой кишке США (103). Основные особенности СРЛЭ по сравнению с радикальной резекцией состоят в следующем: удаляется меньший объём ткани молочной железы (сектор ткани с линией резекции не менее, чем 1,5 см от края опухоли), лимфаденэктомия выполняется из отдельного разреза, то есть операция не является моноблочной. Объём удаляемой регионарной клетчатки такой же, как и при РР.
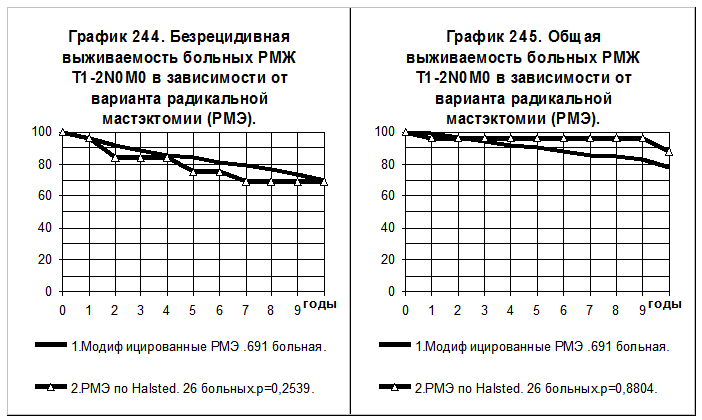
При РМЖ T1-2N0M0 26 больным была выполнена радикальная мастэктомия (по Halsted) и 691 больной — радикальная мастэктомия с сохранением большой грудной мышцы или с сохранением обеих грудных мышц (модифицированная радикальная мастэктомия по Patey или по Madden). Сравнения БРВ и ОВ этих групп больных приведены на графиках 244 и 245. Отсутствуют статистически значимые различия между группами больных по БРВ и по ОВ.
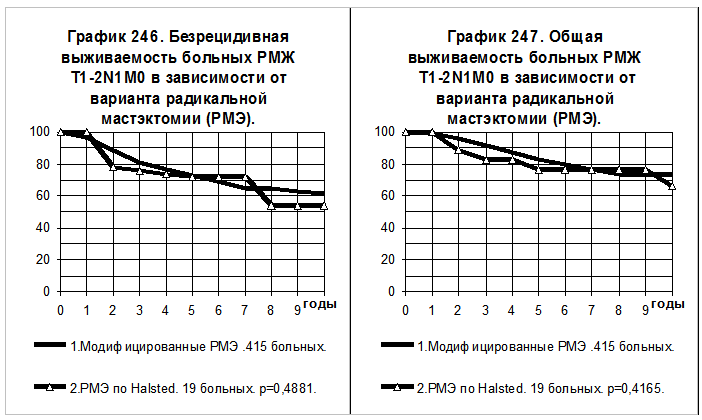
На графиках 246 и 247 представлены кривые БРВ и ОВ больных РМЖ T1-2N1M0 от варианта перенесённых радикальных мастэктомий, статистически значимые различия БРВ и ОВ между группами больных отсутствуют.
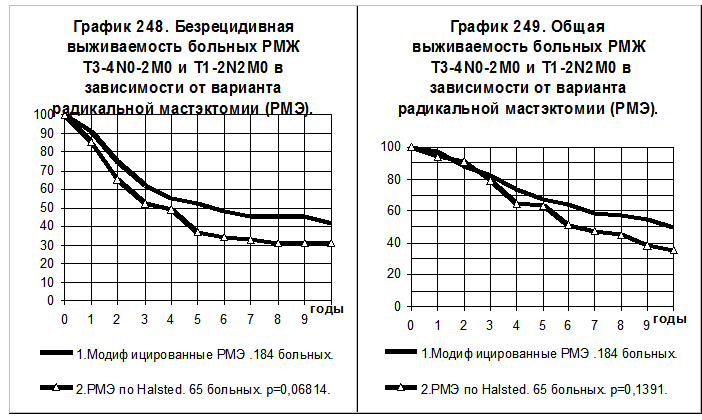
При РМЖ T3-4N0-2M0 и T1-2N2M0 доля радикальной мастэктомии (по Halsted) несколько возросла, она была выполнена 65 больным и 184 больным была выполнена радикальная мастэктомия с сохранением большой грудной мышцы или с сохранением обеих грудных мышц. Сравнения БРВ и ОВ этих групп больных приведены на графиках 248 и 249. Отсутствуют статистически значимые различия между группами больных по БРВ и по ОВ.
Отсутствие статистически значимых различий по показателям БРВ и ОВ между группами больных РМЖ, перенесших различные варианты РМЭ, позволяет при дальнейшем анализе объединить этих больных в одну группу. Рассмотрим влияние на течение болезни органосохраняющих операций в сравнении с такой объединённой группой больных, перенесших РМЭ в одном из её вариантов.
Сравнительная характеристика больных по степени распространенности опухоли, среднему размеру опухоли и частоте некоторых факторов неблагоприятного прогноза в зависимости от вида оперативного вмешательства представлена в таблицах 48, 49 и 50. При анализе левых половин указанных таблиц, относящихся к характеристике всех больных, подвергнутых каждой из операций, можно отметить нарастание частоты обнаружения опухолевых клеток в кровеносных и/или лимфатических сосудах и тенденцию к учащению РП- опухолей с повышением степени распространённости опухоли.
Таблица 48. Частота обнаружения опухолевых клеток в кровеносных и/или лимфатических сосудах и частота РП- опухолей у больных РМЖ T1-2N0-1M0, перенесших радикальную мастэктомию в одном из её вариантов.
|
У всех оперированных больных |
У больных с рецидивом болезни |
|||||
|
Группы больных |
Число больных |
Частота обнаружения опухолевых клеток в сосудах |
Частота РП- опухолей |
Число больных |
Частота обнаружения опухолевых клеток в сосудах |
Частота РП- опухолей |
|
T1N0M0 |
400 |
3*% |
39% |
62 |
5% |
45% |
|
T2N0M0 |
324 |
6% |
56% |
57 |
2% |
68% |
|
T1-2N1M0 |
443 |
9% |
44% |
113 |
11% |
52% |
|
Всего |
1167 |
6% |
46% |
232 |
7% |
54% |
Примечание: *- статистически значимо реже (p<0,05), чем при T2N0M0 и T1-2N1M0.
Сравнивая левые половины с правыми половинами каждой из таблиц, отмечаем своеобразное накопление неблагоприятных факторов прогноза (частоты РП- опухолей, частоты обнаружения опухолевых клеток в кровеносных и/или лимфатических сосудах) у больных с развившимся в последующем возвратом болезни (различия частоты признаков статистически не значимы), это не относится только к частоте обнаружения опухолевых клеток в кровеносных и/или лимфатических сосудах среди больных, перенесших РМЭ.
У больных, перенесших РР, частота обнаружения опухолевых клеток в сосудах выше, чем у больных, оперированных в объёме РМЭ, а у больных, перенесших СРЛЭ — выше, чем у больных, перенесших РР. Этот, возможно, ятрогенный фактор прогноза сопровождал РР в 2 раза чаще, а СРЛЭ — в 3 раза чаще, чем РМЭ. Сходной закономерности не наблюдалось при анализе такого нерукотворного фактора как уровень РП, частота РП- опухолей не коррелировала с видом операции.
Таблица 49. Частота обнаружения опухолевых клеток в кровеносных и/или лимфатических сосудах и частота РП- опухолей у больных РМЖ T1-2N0-1M0, перенесших радикальную резекцию молочной железы.
|
У всех оперированных больных |
У больных с рецидивом болезни |
|||||
|
Группы больных |
Число больных |
Частота обнаружения опухолевых клеток в сосудах |
Частота РП- опухолей |
Число больных |
Частота обнаружения опухолевых клеток в сосудах |
Частота РП- опухолей |
|
T1N0M0 |
90 |
9% |
47% |
7 |
2/7 |
2/6 |
|
T2N0M0 |
25 |
16% |
64% |
7 |
1/7 |
5/7 |
|
T1-2N1M0 |
49 |
18% |
50% |
14 |
36% |
71% |
|
Всего |
164 |
13*% |
51% |
28 |
29% |
63% |
Примечание: * — статистически значимо чаще (p<0,05), чем аналогичный показатель в таблице 48.
У больных с рецидивом болезни после органосохраняющих операций частота обнаружения опухолевых клеток в сосудах примерно в 2 раза выше, чем у больных, перенесших органосохраняющие операции в целом. То есть для больных, перенесших органосохраняющие операции, опухолевые клетки в сосудах являлись значимым фактором плохого прогноза.
Таблица 50. Частота обнаружения опухолевых клеток в кровеносных и/или лимфатических сосудах и частота РП- опухолей у больных РМЖ T1-2N0-1M0, перенесших секторальную резекцию молочной железы с подмышечной лимфаденэктомией.
|
У всех оперированных больных |
У больных с рецидивом болезни |
|||||
|
Группы больных |
Число больных |
Частота обнаружения опухолевых клеток в сосудах |
Частота РП- опухолей |
Число больных |
Частота обнаружения опухолевых клеток в сосудах |
Частота РП- опухолей |
|
T1N0M0 |
57 |
12% |
35% |
13 |
23% |
58% |
|
T2N0M0 |
21 |
24% |
56% |
7 |
3/7 |
4/7 |
|
T1-2N1M0 |
18 |
22% |
53% |
3 |
1/2 |
2/2 |
|
Всего |
96 |
17*% |
42% |
22 |
32% |
62% |
Примечание: * — статистически значимо чаще (р<0,05), чем аналогичный показатель в таблице 48.
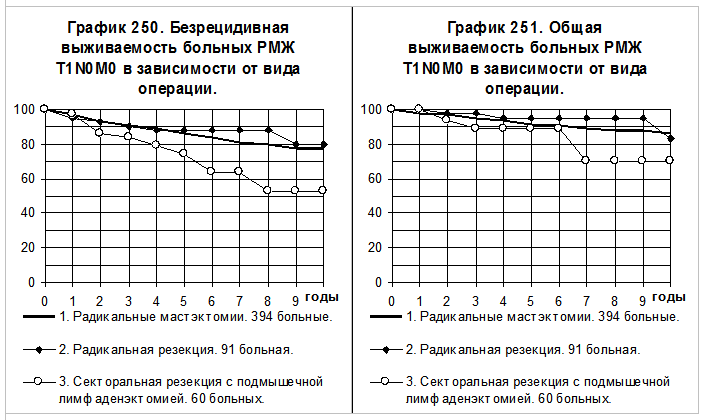
На графиках 250 и 251 представлено сравнение результатов оперативного лечения больных РМЖ T1N0M0. 394 больным была выполнена РМЭ (1-я группа), 91 больной — РР (2-я группа) и 60 больным — СРЛЭ (3-я группа). Результаты лечения по показателям БРВ и ОВ близки при сравнении между собой 1-й и 2-й групп больных. Показатели БРВ больных 3-й группы значительно хуже, чем у больных 1-й группы (р=0,007015) и у больных 2-й группы (р=0,01079); различия ОВ статистически не значимы.
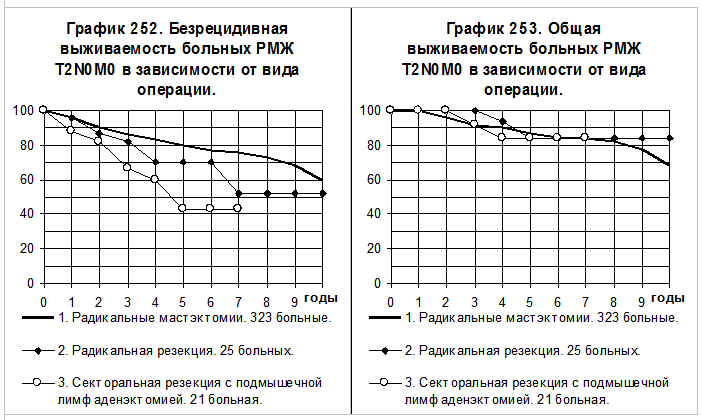
У больных РМЖ T2N0M0 аналогичное сравнение отдалённых результатов оперативного лечения демонстрируют графики 252 и 253. Первую группу составили 323 больных, перенесших РМЭ, вторую — 25 больных, перенесших РР и третью группу — 21 больная, перенесшая СРЛЭ. В группе больных, перенесших РР, наметилась выраженная тенденция к ухудшению показателей БРВ по сравнению с больными 1-й группы. Показатели БРВ больных 3-й группы статистически значимо ниже, чем у больных 1-й группы, различия с больными 2-й группы статистически не значимы. Различия показателей ОВ между группами больных существенно не отличались.
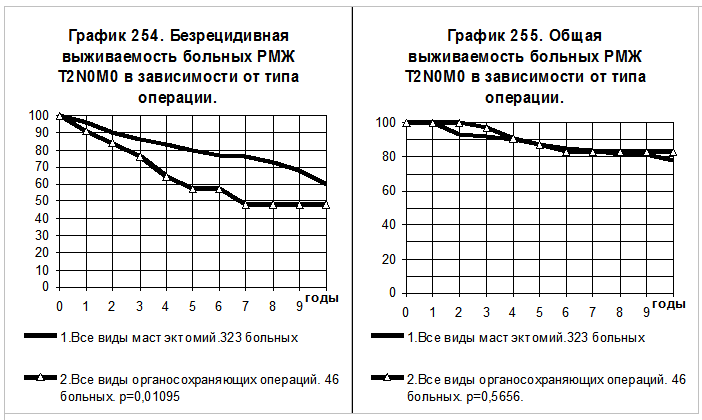
На графиках 254 и 255 представлено сравнение БРВ и ОВ больных РМЖ T2N0M0 оперированных в объёме радикальной мастэктомии в одном из её вариантов (1 группа, 323 больных) и объединённой группы больных, перенесших органосохраняющие операции (2 группа, 46 больных). Показатели БРВ 2-й группы больных статистически значимо ниже, чем показатели БРВ больных 1-й группы (р=0,01095), причём из 17 рецидивов болезни во 2-й группе больных только в 1 случае наблюдался местный рецидив в молочной железе. Показатели ОВ в сравниваемых группах больных близки, наблюдается незначительная противоположная тенденция — к более высоким показателям ОВ у больных 2 группы по сравнению с больными 1-й группы.
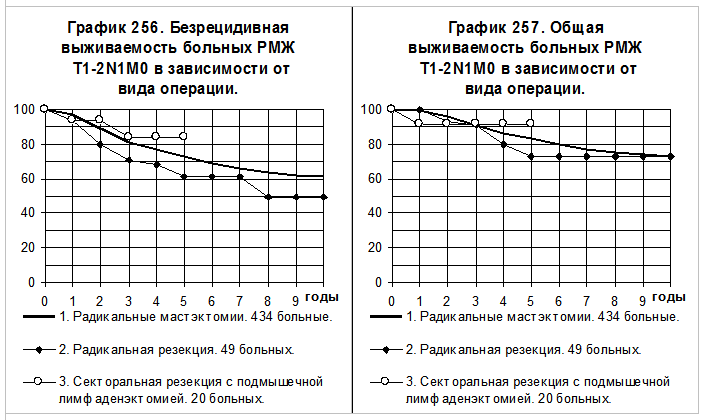
При РМЖ T1-2N1M0 РМЭ была выполнена 434 больным (1-я группа), РР — 49 больным (2-я группа) и СРЛЭ — 20 больным (3-я группа). При сравнении БРВ и ОВ между группами больных (графики 256 и 257) не получено статистически значимых различий, хотя наблюдалась выраженная тенденция к понижению показателей БРВ больных 2-й группы по сравнению с больными 1-й группы (р=0,08610).
12.3. Эндокринная терапия с применением тамоксифена.
Приём тамоксифена (нолвадекса, зитазониума) производился по 20 мг в сутки в течение 2 лет после операции. Показаниями к назначению препарата были: местное или регионарное, или местно-регионарное распространение болезни (T3-4N0M0, T1-2N1-2M0, T3-4N1-2M0) у больных с РЭ+ и/или РП+ опухолями (число больных в соответствующих группах приведено на графиках 264 — 273). Часть больных с локализованными формами болезни (T1-2N0M0) и РЭ+ и/или РП+ опухолями, вошедшие в рандомизированное исследование, так же получали тамоксифен (число таких больных приведено на графиках 258 — 263). Кроме того, в некоторых случаях приём препарата производился по рекомендациям онкологов по месту жительства больных вне указанных показаний.
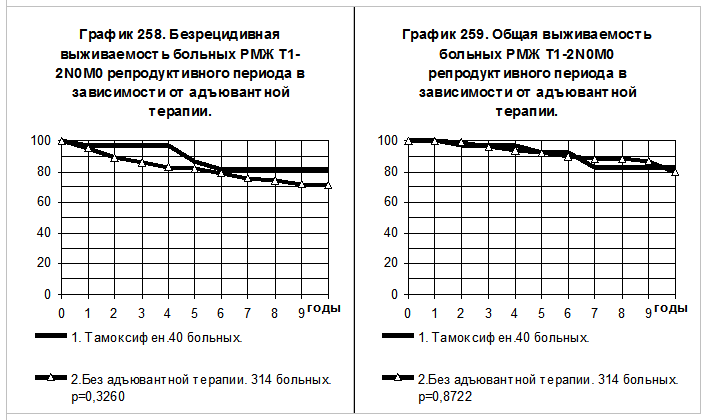
Графики 258 и 259 демонстрируют сравнение показателей БРВ и ОВ больных РМЖ T1-2N0M0 репродуктивного периода. Больные (40) 1-й группы получали тамоксифен, причём только 2 больным производилось удаление яичников и 3 больным — лучевое подавление их функции. Больным
2-й группы (314) адъювантная системная терапия не проводилась. Отмечаются тенденции к повышению показателей БРВ и ОВ больных 1-й группы по сравнению с больными 2-й группы, различия статистически не значимы. При грубом сравнении частоты событий за весь период наблюдений получилось, что частота рецидива болезни в 1-й группе была в 2,3 раза ниже, а частота смерти — в 1,5 раза ниже, чем соответствующие показатели во 2-й группе больных.
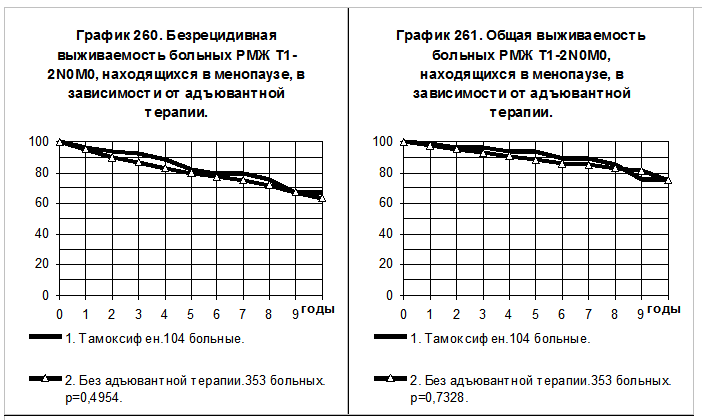
У больных РМЖ T1-2N0M0, находящихся в менопаузе, приём тамоксифена также сопровождается тенденциями к повышению БРВ и ОВ по сравнению с БРВ и ОВ больных, не получавших адъювантной системной терапии (смотри графики 260 и 261). Частота развития рецидива болезни у первых была в 1,7 раза, а частота смерти — в 1,6 раза ниже, чем у вторых.
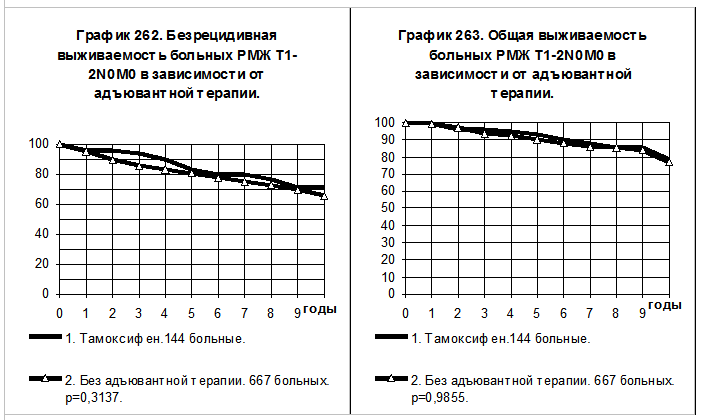
При сравнении объединённых групп больных РМЖ T1-2N0M0 вне зависимости от репродуктивного статуса, тенденции к более высоким значениям БРВ и ОВ больных, получавших тамоксифен, сохраняются, различия показателей статистически не значимыми (смотри графики 262 и 263).
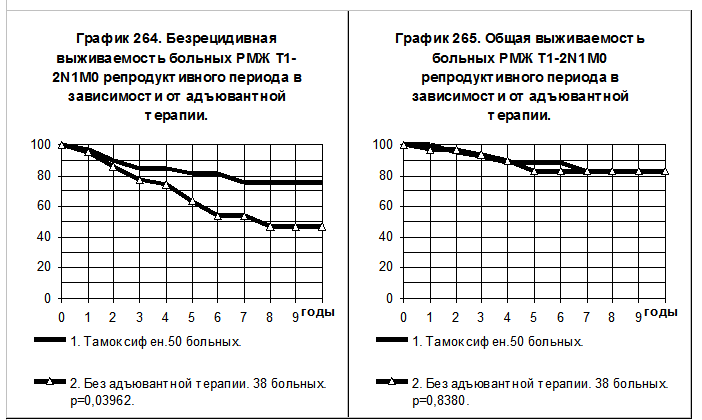
Чем быстрее естественное течение болезни, тем статистически достовернее преимущества в БРВ больных, получавших адъювантное лечение. На графиках 264 и 265 представлено сравнение показателей БРВ и ОВ больных РМЖ T1-2N1M0 репродуктивного периода, получавших тамоксифен (50 больных, 1-я группа) и не получавших никакой адъювантной терапии (38 больных, 2-я группа). 28 больным 1-й группы эндокринная терапия была начата с удаления яичников (24 больные) или лучевого подавления их функции (4 больные), 30 больным кроме того проводилась химиотерапия. БРВ больных 1-й группы была статистически значимо выше (р=0,0396) чем БРВ больных 2-й группы, преимущества ОВ больных 1-й группы имели характер слабой тенденции. Частота рецидива болезни в 1-й группе была в 2,5 раза ниже, а частота смерти — в 1,3 раза ниже, чем соответствующие показатели во 2-й группе больных.
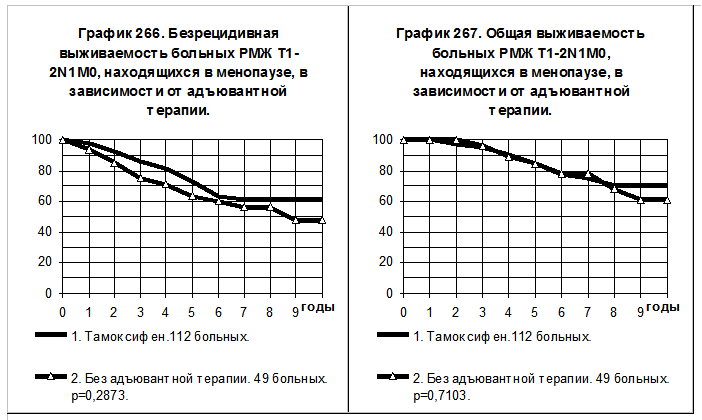
У больных РМЖ T1-2N1M0, находящихся в менопаузе, 1-ю группу составили 112 больных, получавших тамоксифен (в том числе 29 получали и химиотерапию), 2-ю группу составили 49 больных, не получавших никакой адъювантной терапии. Показатели БРВ и ОВ больных 1-й группы имеют тенденцию к более высоким значениям по сравнению с соответствующими показателями больных 2-й группы (смотри графики 266 и 267). Частота рецидива болезни и частота смерти за всё время наблюдений в 1-й группе были в 1,5 раза ниже, чем во 2-й.
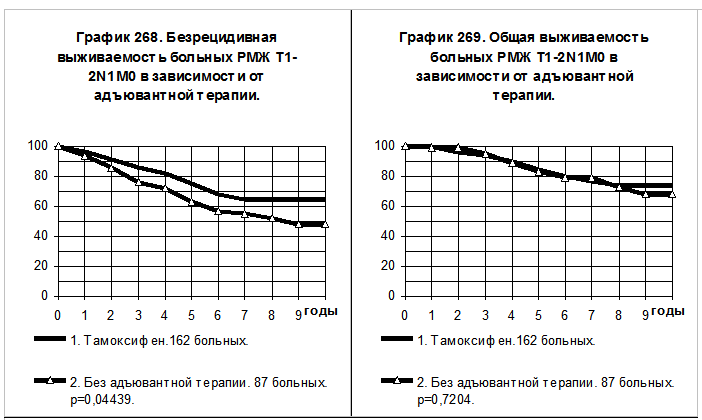
При объединении групп больных РМЖ T1-2N0M0 вне зависимости от репродуктивного статуса у больных, получавших эндокринную терапию тамоксифеном (+/- химиотерапию), сохраняются более высокие значения БРВ (р=0,04439) и ОВ (различия статистически не значимы), по сравнению с больными, не получавшими адъювантной системной терапии (графики 268 и 269).
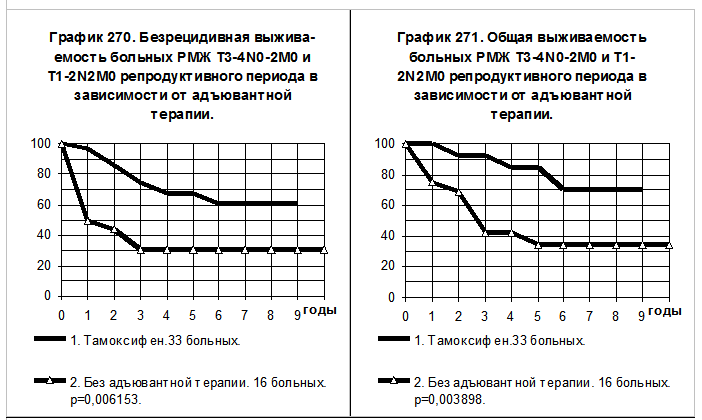
Графики 270 и 271 демонстрируют сравнение показателей БРВ и ОВ больных РМЖ T3-4N0-2M0 и T1-2N2M0 репродуктивного периода. 33
больные 1-й группы получали тамоксифен, из них 12 больным производилось удаление яичников, 13 больным — лучевое подавление их функции; 21, кроме того проводилась химиотерапия. 16 больным 2-й группы адъювантная системная терапия не проводилась. Наблюдаются выраженные преимущества по БРВ (р=0,00615) и по ОВ (р=0,00390) больных 1-й группы по сравнению с больными 2-й группы. При грубом сравнении частоты событий за весь период наблюдений получилось, что частота рецидива болезни в 1-й группе была в 2,5 раза ниже, а частота смерти — в 5,0 раз ниже, чем соответствующие показатели во 2-й группе больных.
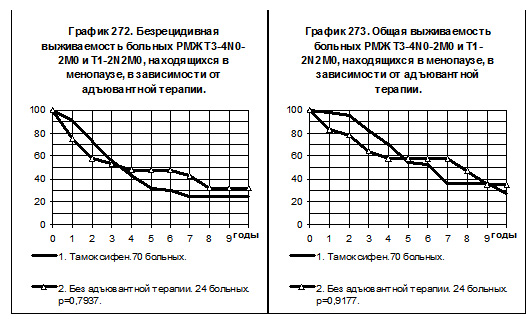
Среди больных РМЖ T3-4N0-2M0 и T1-2N2M0, находящихся в менопаузе, 70 пациенток 1-й группы принимали тамоксифен (в том числе 38 получали и химиотерапию), и 24 пациентки не получали системной терапии (смотри графики 272 и 273). У больных 1-й группы не отмечено преимуществ БРВ, наблюдалась слабая тенденция к повышению показателей ОВ по сравнению со второй группой больных.
12.4. Адъювантная химиотерапия.
Адъювантная химиотерапия проводилась 435 больным, в том числе: монохимиотерапия тиофосфамидом (по 20 мг в/м через день до суммарной дозы 80 мг/м2, 4 курса с интервалом 2,5 — 3 месяца) — 63, комбинированная химиотерапия по схеме CMF (циклофосфан по 100 мг/м2 через рот или в/м 1-14 дни, метотрексат по 40 мг/м2 в/в 1 и 8 дни, 5-фторурацил по 600 мг/м2 в/в 1 и 8 дни) — 281, по модифицированной схеме Купера (VCMFP, винкристин по 1,0 мг/м2 в/в 1 и 8 дни, циклофосфан по 100 мг/м2 через рот или в/м 1-14 дни, метотрексат по 40 мг/м2 в/в 1 и 8 дни, 5-фторурацил по 600 мг/м2 в/в 1 и 8 дни, преднизолон по 30 — 40 мг через рот 1 — 14 дни) — 13, по схеме CAF (циклофосфан по 100 мг/м2 через рот или в/м 1-14 дни, доксорубицин по 40 мг/м2 в/в 1 и 8 дни, 5-фторурацил по 600 мг/м2 в/в 1 и 8 дни) — 14, VCAF (винкристин по 1,0 мг/м2 в/в 1 день, циклофосфан по 300 мг/м2 в/м 1-5 дни, доксорубицин по 40 мг/м2 в/в 1 день, 5-фторурацил по 600 мг/м2 в/в 1 день) — 15, VAM (винкристин 1,0 мг/м2 в/в 1 день, доксорубицин 40 мг/м2 в/в 2 день и метотрексат 40 мг/м2 в/в 3-й день) -31, АС (доксорубицин 50 мг/м2 и циклофосфан 500 мг/м2 — 1 день) — 4, CMFAV (винкристин 1,0 мг/м2 в/в и доксорубицин 30 мг/м2 в/в 1 день, метотрексат 40 мг/м2 в/в и доксорубицин 30 мг/м2 в/в 8 день, 5-фторурацил по 600 мг/м2 и доксорубицин 30 мг/м2 в/в 15 день, циклофосфан по 500 мг/м2 и доксорубицин 30 мг/м2 в/в 21 день) — 5 и CMFA(циклофосфан по 100 мг/м2 через рот или в/м 1-14 дни, метотрексат по 40 мг/м2 в/в 1 и 8 дни, 5-фторурацил по 600 мг/м2 в/в 1 и 8 дни, доксорубицин по 40 мг/м2 в/в 1 день) — 9 больным.
Показанием к проведению адъювантной химиотерапии считалось местное или регионарное, или местно-регионарное распространение опухоли (T3-4N0M0, T1-2N1-2M0, T3-4N1-2M0). Химиотерапия по схеме Купера и по схемам, включающим доксорубицин, преимущественно проводилась при РМЖ III стадии (T1-2N2M0, T3-4N1-2M0), хотя часто применялась и химиотерапия по схеме CMF. Основной схемой адъювантной химиотерапии РМЖ T1-2N1M0 была схема CMF, однако применялись и другие схемы химиотерапии, в том числе монохимиотерапия тиофосфамидом. Часть больных с локализованными формами болезни (T1-2N0M0), вошедшие в рандомизированное исследование, или больные с морфологически неблагоприятными вариантами опухоли (3 степень злокачественности, наличие опухолевых клеток в лимфатических и/или кровеносных сосудах) также получали химиотерапию тиофосфамидом или по схеме CMF. Кроме того, в некоторых случаях приём препарата производился по рекомендациям онкологов по месту жительства больных вне указанных показаний.
Осуществлялась рекомендованная адъювантная химиотерапия в большинстве случаев амбулаторно под наблюдением онколога по месту жительства. Вид, доза и режим химиотерапии зависели от слишком большого количества факторов: научных тематик отделений ОНЦ, точки зрения онколога по месту жительства, доступности рекомендованных препаратов, желания больной, объективной и субъективной переносимости химиотерапии и так далее … В итоге большинство больных не получили рекомендованное лечение в адекватных дозах в оптимальные сроки.
Оценка влияния адъювантной химиотерапии на течение болезни производилась, в основном, двумя путями. Во-первых, с помощью сравнения кривых БРВ и ОВ больных, стратифицированных по степени распространённости опухоли и по интенсивности дозы препарата. Во-вторых, с помощью оценки сбалансированности самой частой схемы химиотерапии, — схемы CMF.
12.4.1. Интенсивность дозы.
Интенсивность дозы препаратов за период первых 6 месяцев, следующих после операции, вычислялась в миллиграммах на квадратный метр площади поверхности тела за неделю по формуле:
ИД= СД : Пл : 26, где:
СД — суммарная доза препарата, полученная за 6 месяцев после
операции,
Пл — площадь поверхности тела в м2,
26 — число недель в 6 месяцах.
Больные, получавшие анализируемый препарат, в зависимости от отношения полученной ими интенсивности дозы к расчётной интенсивности дозы разбивались на 3 группы: 1) с низкой ИД (менее 50% от расчётной), 2) со средней ИД (50 — 90% от рассчётной) и 3) с нормальной ИД (больше 90% от расчётной).
12.4.1.1. Тиофосфамид.
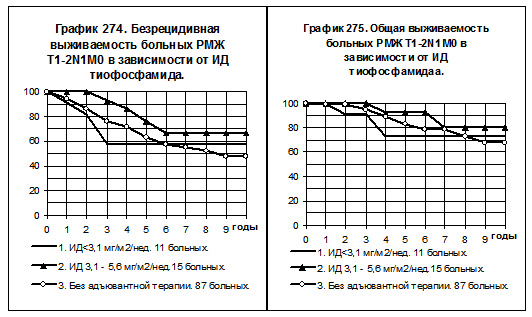
Тиофосфамид в качестве адъювантной монохимиотерапии получали 63 больные, в том числе: 15 больных РМЖ T1-2N0M0, 30 больных РМЖ T1-2N1M0, 18 больных РМЖ T3-4N0-2M0 и T1-2N2M0. Предполагалось, что больная, получая препарат по 20 мг в/м через день до суммарной дозы 80 мг/м2 с интервалом 2,5 — 3 месяца, за 6 месяцев получит 2 курса химиотерапии, тогда рассчётная ИД составит 80 х 2 : 26 = 6,2 мг/м2 за неделю. В интервал с низкой интенсивностью дозы включались больные с ИД <3,1 мг/м2 за неделю, в интервал со средней ИД — больные с ИД от 3,1 до 5,6 мг/м2 за неделю и в интервал с нормальной ИД — больные с ИД >5,6 мг/м2 за неделю.
Прямое сравнение кривых БРВ и ОВ возможно только для РМЖ T1-2N1M0 (смотри графики 274 и 275). Представлены группы больных: 1) с низкой ИД (11 больных), 2) со средней ИД (15 больных) и 3) не получавшие никакой адъювантной системной терапии (87 больных). Тиофосфамид с нормальной ИД получали только 4 больных, они на графике не представлены из-за малочисленности группы. Показатели БРВ и ОВ больных 1-й и 3-й групп идентичны. Во 2-й группе больных отмечается тенденция к более высоким показателям БРВ и ОВ по сравнению с больными 1-й и 3-й групп, различия статистически не значимы.
12.4.1.2. Циклофосфан.
Циклофосфан в составе различных схем химиотерапии получали 346 больных, в том числе: 27 больных РМЖ T1-2N0M0, 197 больных РМЖ T1-2N1M0, 122 больных РМЖ T3-4N0-2M0 и T1-2N2M0.
При рассчёте должной интенсивности дозы предполагалось, что больная, начиная через 2 недели после операции и получая препарат по 100 мг/м2 с 1 по 14 дни стандартного курса химиотерапии с интервалом 3 недели, за 6 месяцев получит 5 курсов химиотерапии, тогда рассчётная ИД составит 100 х 14 х 5 : 26 = 269 мг/м2 за неделю. В интервал с низкой интенсивностью дозы включались больные с ИД <135 мг/м2 за неделю, в интервал со средней ИД — больные с ИД от 135 до 242 мг/м2 за неделю и в интервал с нормальной ИД — больные с ИД >242 мг/м2 за неделю.
При РМЖ T1-2N0M0 анализ БРВ и ОВ не проводился из-за малого числа больных, получавших циклофосфан.
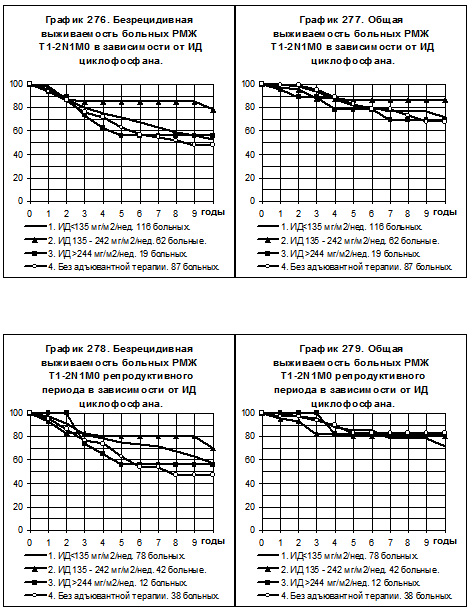
Среди больных РМЖ T1-2N1M0, получавших циклофосфан, представлены 3 группы: 1) с низкой ИД -116 больных, 2) со средней ИД — 62 больных, 3) с нормальной ИД — 19 больных; 4-ю группу составили 87 больных, не получавших никакой адъювантной системной терапии (смотри графики 276 и 277). У больных 1 группы отмечена тенденция к повышению БРВ (но не ОВ) по сравнению с больными 4-й группы. У больных 2-й группы наблюдались самые высокие показатели БРВ и ОВ по сравнению со всеми остальными группами больных, различия БРВ статистически значимы (р<0,05), различия ОВ имеют характер тенденции. В очень незначительной по числу больных 3-й группе показатели БРВ и ОВ не отличались от соответствующих показателей 4-й группы больных.
Разделение больных РМЖ T1-2N1M0 по репродуктивному статусу показало сохранение указанных тенденций по БРВ среди больных репродуктивного периода (смотри график 278); то есть, БРВ больных, получавших циклофосфан с низкой интенсивностью дозы, имела слабую тенденцию к превышению БРВ больных, не получавших адъювантной терапии; БРВ больных, получавших циклофосфан со средней интенсивностью дозы, была наивысшей; и БРВ больных, получавших препарат с нормальной интенсивностью дозы, оказалось столь же низкой, как и у больных без адъювантной терапии. Показатели ОВ (смотри график 279) не имели тенденций к различиям между группами.
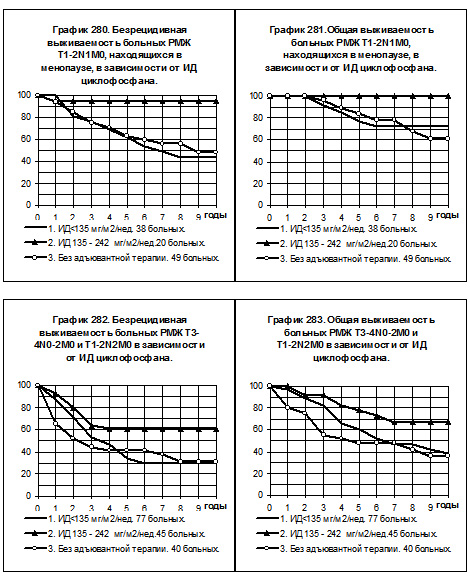
У больных РМЖ T1-2N1M0, находящихся в менопаузе, только 7 пациенток получали циклофосфан с нормальной интенсивностью дозы, эта группа не представлена в анализе БРВ и ОВ (смотри графики 280 и 281). В 1-ю группу с низкой интенсивностью дозы препарата вошли 38 больных, во 2-ю группу со средней интенсивностью дозы — 20 больных, 3-я группа представлена 49 больными, не получавшими адъювантной системной терапии. Показатели БРВ и ОВ больных 1-й группы не отличаются от соответствующих показателей больных 3-й группы. БРВ и ОВ больных 2-й группы статистически значимо выше, чем таковые больных 1-й группы и 3-й группы (р<0,05).
У больных РМЖ T3-4N0-2M0 и T1-2N2M0 сравнивались БРВ и ОВ в следующих группах: 1) 77 больных, получавших циклофосфан с низкой интенсивностью дозы, 2) 45 больных, получавших препарат со средней интенсивностью дозы, 3) 40 больных без адъювантной системной терапии (смотри графики 282 и 283). Циклофосфан с нормальной интенсивностью дозы получили только 3 больных. БРВ больных 1-й и 3-й групп практически одинаковы, показатели ОВ имеют тенденцию к некоторому повышению у больных 1-й группы по сравнению со 3-й группой. Самая высокая БРВ и ОВ наблюдались у больных 2-й группы, различия показателей статистически достоверны при их сравнении и с 1-й, и с 3-й группами (р<0,05).
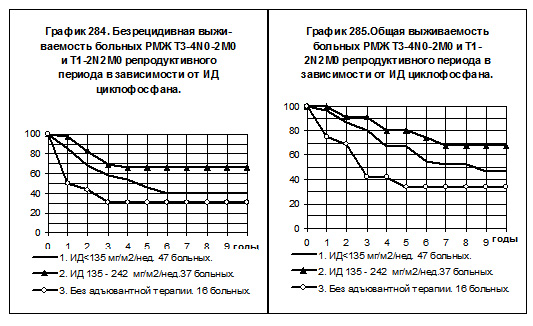
В том числе у больных РМЖ T3-4N0-2M0 и T1-2N2M0 репродуктивного периода (смотри графики 284 и 285) воспроизводятся аналогичные закономерности: различия БРВ и ОВ между 1-й и 3-й группами статистически не значимы, хотя имеется тенденция к повышению показателей у больных 1-й группы. У больных 2-й группы показатели БРВ статистически значимо превышают таковые больных всех других групп (р<0,05), показатели ОВ максимальные, различия с показателями ОВ больных 1-й группы имеют характер тенденции (р=0,1476), а с показателями ОВ 3-й группы статистически значимы (р=0,00287).
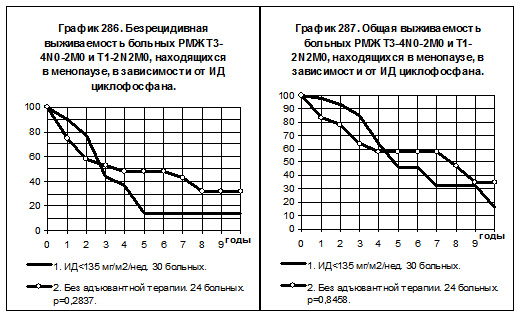
У больных РМЖ T3-4N0-2M0 и T1-2N2M0, находящихся в менопаузе, пациенток со средней интенсивностью дозы циклофосфана было всего 8, они исключены из анализа БРВ и ОВ. На графиках 286 и 287 представлено сравнение двух групп больных, больные 1-й группы (30 ) получали циклофосфан с низкой интенсивностью дозы, больные 2-й группы не получали адъювантной системной терапии. Очевидно отсутствие намёков на повышение показателей БРВ и ОВ среди больных 1-й группы по сравнению с больными 2-й группы.
12.4.1.3. Метотрексат.
Метотрексат в составе различных схем химиотерапии получали 280 больных, в том числе: 27 больных РМЖ T1-2N0M0, 169 больных РМЖ T1-2N1M0, 111 больных РМЖ T3-4N0-2M0 и T1-2N2M0.
При рассчёте должной интенсивности дозы предполагалось, что больная, начиная через 2 недели после операции и получая препарат по 25* мг/м2 1 и 8 дни стандартного курса химиотерапии с интервалом 3 недели, за 6 месяцев получит 5 курсов химиотерапии, тогда рассчётная ИД составит 25* х 2 х 5 : 26 = 9,6 мг/м2 за неделю. В интервал с низкой интенсивностью
дозы включались больные с ИД < 4,8 мг/м2 за неделю, в интервал со средней ИД — больные с ИД от 4,8 до 8,6 мг/м2 за неделю и в интервал с нормальной ИД — больные с ИД >8,6 мг/м2 за неделю.
——————-
Примечание: * — в связи с плохой переносимостью метотрексата, его рассчётная доза в большинстве случаев была снижена с 40 мг/м2 до 25 мг/м2.
При РМЖ T1-2N0M0 анализ БРВ и ОВ не проводился из-за малого числа больных, получавших метотрексат.
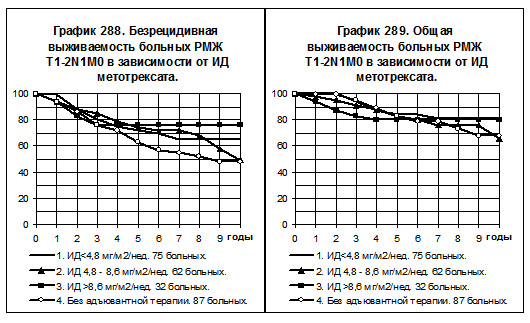
Среди больных РМЖ T1-2N1M0, получавших метотрексат, представлены 3 группы: 1) с низкой ИД -75 больных, 2) со средней ИД — 62 больных, 3) с нормальной ИД — 32 больных; 4-ю группу составили 87 больных, не получавших никакой адъювантной системной терапии. У больных 1 и 2 групп отмечена тенденция к повышению БРВ по сравнению с больными 4-й группы, показатели БРВ больных 1-й и 2-й групп идентичны (смотри график 288). У больных 3-й группы наблюдались самые высокие показатели БРВ по сравнению со всеми остальными группами больных, однако различия статистически не значимы. Не отмечено тенденций к различиям между группами при анализе ОВ (смотри график 289).
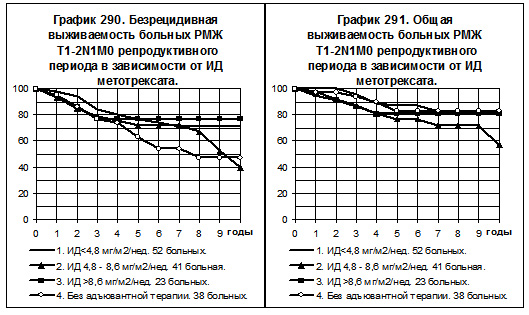
Разделение больных РМЖ T1-2N1M0 по репродуктивному статусу показало сохранение указанных тенденций по БРВ среди больных репродуктивного периода (смотри график 290); то есть, БРВ больных, получавших метотрексат с низкой и средней интенсивностью дозы, имела слабую тенденцию к превышению БРВ больных, не получавших адъювантной терапии; БРВ больных, получавших метотрексат с нормальной интенсивностью дозы, была наивысшей. Показатели ОВ (смотри график 291) не имели тенденций к различиям между группами, за исключением больных 2-й группы, у которых отмечена тенденция к ухудшению показателей ОВ по сравнению с соответствующими показателями всех других групп.
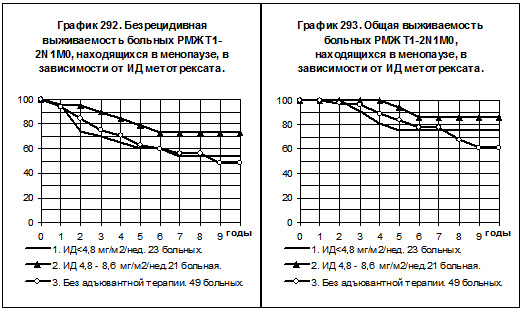
У больных РМЖ T1-2N1M0, находящихся в менопаузе, только 9 пациенток получали метотрексат с нормальной интенсивностью дозы, эта группа не представлена в анализе БРВ и ОВ (смотри графики 292 и 293). В
1-ю группу с низкой интенсивностью дозы препарата вошли 23 больные, во 2-ю группу со средней интенсивностью дозы — 21 больная, 3-я группа представлена 49 больными, не получавшими адъювантной системной терапии. Показатели БРВ и ОВ больных 1-й группы не отличаются от соответствующих показателей больных 3-й группы. БРВ и ОВ больных 2-й группы несколько выше, чем соответствующие показатели больных 1-й группы и 3-й группы, различия статистически не значимы.
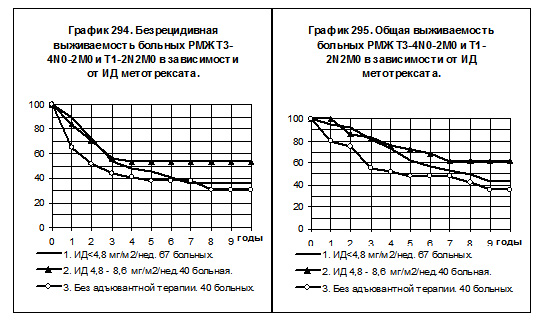
У больных РМЖ T3-4N0-2M0 и T1-2N2M0 сравнивались БРВ и ОВ в следующих группах: 1) 67 больных, получавших метотрексат с низкой интенсивностью дозы, 2) 40 больных, получавших препарат со средней интенсивностью дозы, 3) 40 больных без адъювантной системной терапии (смотри графики 294 и 295). Метотрексат с нормальной интенсивностью дозы получили
только 4 больных. БРВ и ОВ больных 1-й группы имеет тенденцию к более высоким значениям по сравнению с показателями больных 3-й группы. Самые высокие показатели БРВ и ОВ наблюдались у больных 2-й группы, различия показателей ОВ статистически достоверны при их сравнении с 3-й группой (р=0,04253).
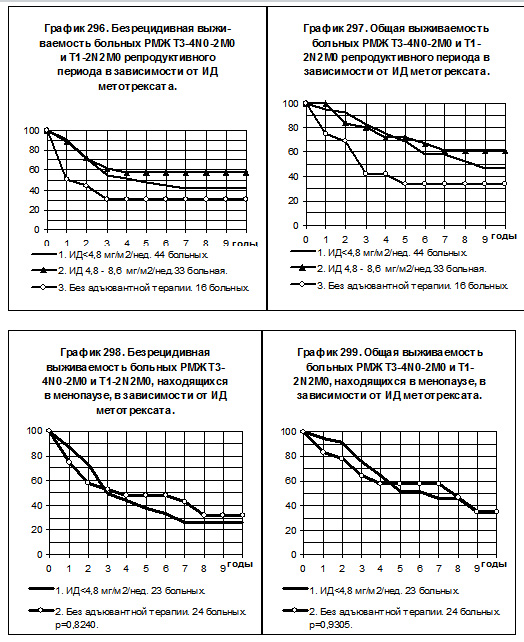
В том числе у больных РМЖ T3-4N0-2M0 и T1-2N2M0 репродуктивного периода (смотри графики 296 и 297) воспроизводятся закономерности, характерные для всего массива больных: различия БРВ между 1-й и 3-й группами статистически не значимы, хотя имеется тенденция к повышению показателей у больных 1-й группы, а различия по ОВ статистически значимы, р=0,0336. У больных 2-й группы показатели БРВ и ОВ максимальны, их различия статистически значимы при сравнении с соответствующими показателями больных 3-й группы (р<0,05).
У больных РМЖ T3-4N0-2M0 и T1-2N2M0, находящихся в менопаузе, пациенток со средней интенсивностью дозы метотрексата было всего 7, они исключены из анализа БРВ и ОВ. На графиках 298 и 299 представлено сравнение двух групп больных, больные 1-й группы (23 ) получали метотрексат с низкой интенсивностью дозы, больные 2-й группы (24) не получали адъювантной системной терапии. Отсутствуют тенденции к повышению показателей БРВ и ОВ среди больных 1-й группы по сравнению с больными 2-й группы.
12.4.1.4. 5-фторурацил
5-фторурацил в составе различных схем химиотерапии получали 321 больная, в том числе: 27 больных РМЖ T1-2N0M0, 182 больных РМЖ T1-2N1M0, 112 больных РМЖ T3-4N0-2M0 и T1-2N2M0.
При рассчёте должной интенсивности дозы предполагалось, что больная, начиная через 2 недели после операции и получая препарат по 600 мг/м2 1 и 8 дни стандартного курса химиотерапии с интервалом 3 недели, за 6 месяцев получит 5 курсов химиотерапии, тогда рассчётная ИД составит 600 х 2 х 5 : 26 = 231 мг/м2 за неделю. В интервал с низкой интенсивностью дозы включались больные с ИД <116 мг/м2 за неделю, в интервал со средней ИД — больные с ИД от 116 до 208 мг/м2 за неделю и в интервал с нормальной ИД — больные с ИД >208 мг/м2 за неделю.
При РМЖ T1-2N0M0 анализ БРВ и ОВ не проводился из-за малого числа больных, получавших 5-фторурацил.
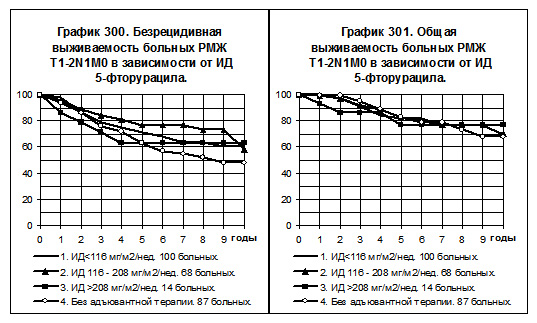
Среди больных РМЖ T1-2N1M0, получавших 5-фторурацил, представлены 3 группы: 1) с низкой ИД -100 больных, 2) со средней ИД — 68 больных, 3) с нормальной ИД — 14 больных; 4-ю группу составили 87 больных, не получавших никакой адъювантной системной терапии (смотри графики 300 и 301). У больных 1 группы отмечена тенденция к повышению БРВ и ОВ по сравнению с больными 4-й группы. У больных 2-й группы наблюдались более высокие показатели БРВ по сравнению с больными 4-й группы (р=0,04598), и тенденция к повышению ОВ по сравнению с больными 4-й группы. У больных 3-й группы показатели БРВ и ОВ имеют слабую тенденцию к повышению по сравнению с соответствующими показателями больных 4-й группы. Среди групп больных, получавших 5-фторурацил, несколько выше были показатели БРВ у больных 2-й группы, однако различия статистически не значимы.
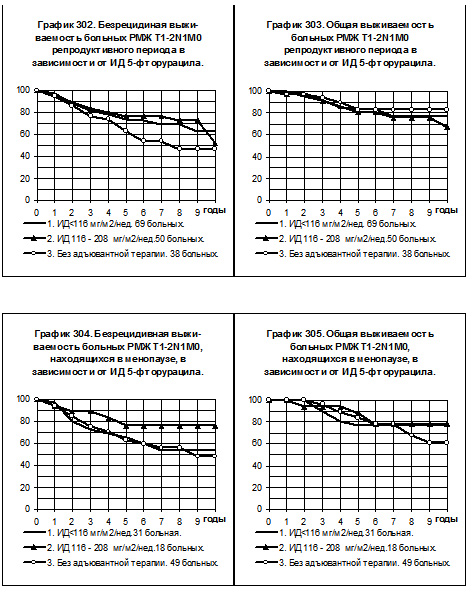
У больных РМЖ T1-2N1M0 репродуктивного периода число больных, получавших нормальные дозы препарата (9), не позволяет включать их в анализ. В 1-ю группу вошли 69 больных, получавших 5-фторурацил в низких дозах, во 2-ю группу — 50 больных, получавших 5-фторурацил в средних дозах и в 3-ю — 38 больных, не получавших адъювантной системной терапии. Показатели БРВ 1-й и 2-й групп практически не отличались друг от друга, но превышали показатели БРВ больных 3-й группы (различия статистически не значимы, смотри график 302). Показатели ОВ всех сравниваемых групп были близки (смотри график 303).
У больных РМЖ T1-2N1M0, находящихся в менопаузе, только 5 пациенток получали 5-фторурацил с нормальной интенсивностью дозы, эта группа не представлена в анализе БРВ и ОВ (смотри графики 304 и 305). В 1-ю группу с низкой интенсивностью дозы препарата вошла 31 больная, во 2-ю группу со средней интенсивностью дозы — 18 больных, 3-я группа представлена 49 больными, не получавшими адъювантной системной терапии. Показатели БРВ и ОВ больных 1-й группы не отличаются от соответствующих показателей больных 3-й группы. БРВ и ОВ больных 2-й группы несколько выше соответствующих показателей больных 1-й группы и 3-й группы, различия статистически не значимы.
У больных РМЖ T3-4N0-2M0 и T1-2N2M0 сравнивались БРВ и ОВ в следующих группах: 1) 60 больных, получавших 5-фторурацил с низкой интенсивностью дозы, 2) 49 больных, получавших препарат со средней интенсивностью дозы, 3) 40 больных без адъювантной системной терапии (смотри графики 306 и 307). 5-фторурацил с нормальной интенсивностью дозы получили только 3 больных, они не включены в анализ выживаемости. БРВ больных 1-й группы несколько выше, чем БРВ больных 3-й группы, а различие показателей ОВ в этой паре статистически значимо (р=0,02349). Различия БРВ и ОВ между 1-й и 2-й группами незначительны и статистически не значимы.
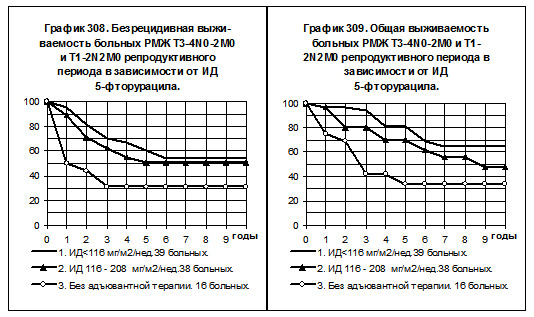
В том числе у больных РМЖ T3-4N0-2M0 и T1-2N2M0 репродуктивного периода (смотри графики 308 и 309) 1-ю группу составили 39 больных, получавших 5-фторурацил с низкой интенсивностью дозы, 2-ю — 38 больных, получавших препарат со средней интенсивностью дозы, и 3-ю — 16 больных без адъювантной системной терапии. Только 1 больная получала препарат с нормальной интенсивностью дозы. Показатели БРВ и ОВ оказались самыми высокими у больных 1-й группы, различия с соответствующими показателями больных 3-й группы статистически значимы, р=0,007689 для БРВ и р=0,001897 для ОВ. У больных 2-й группы БРВ и ОВ несколько ниже, чем у больных 1-й группы, но выше, чем у больных 3-й группы, различия статистически значимы только для БРВ (р=0,02099). Статистически значимых различий между показателями БРВ и ОВ больных 1 -й и 2-й групп не обнаружено.
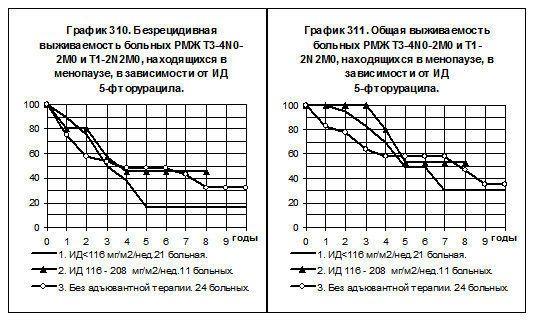
У больных РМЖ T3-4N0-2M0 и T1-2N2M0, находящихся в менопаузе, пациенток с нормальной интенсивностью дозы 5-фторурацила было всего 2, они исключены из анализа БРВ и ОВ (смотри графики 310 и 311). 21 больная получала препарат с низкой интенсивностью дозы (1-я группа), 11 больных получали препарат со средней интенсивностью дозы (2-я группа) и 24 больные не получали адъювантной системной терапии (3-я группа). Самые низкие показатели БРВ и ОВ отмечены у больных 1-й группы, самые высокие — у больных второй группы, однако различия статистически не значимы.
12.4.1.5. Винкристин
Винкристин в составе различных схем химиотерапии получали 65 больных РМЖ T3-4N0-2M0 и T1-2N2M0.
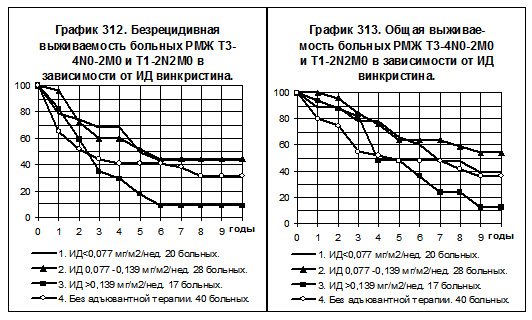
При рассчёте должной интенсивности дозы предполагалось, что больная, начиная через 2 недели после операции и получая препарат по 1 мг/м2 в 1 день курса химиотерапии с интервалом 3 недели, за 6 месяцев должна получить 4 курса химиотерапии, тогда рассчётная ИД составит 1 х 4 : 26 = 0,154 мг/м2 за неделю. В интервал с низкой интенсивностью дозы включались больные с ИД <0,077 мг/м2 за неделю, в интервал со средней ИД — больные с ИД от 0,077 до 0,139 мг/м2 за неделю и в интервал с нормальной ИД — больные с ИД >0,139 мг/м2 за неделю.
У больных РМЖ T3-4N0-2M0 и T1-2N2M0 сравнивались БРВ и ОВ в следующих группах: 1) 20 больных, получавших винкристин с низкой интенсивностью дозы, 2) 28 больных, получавших препарат со средней интенсивностью дозы, 3) 17 больных, получавших препарат с нормальной интенсивностью дозы, 4) 40 больных без адъювантной системной терапии (смотри графики 312 и 313). БРВ больных 1-й и 2-й групп практически одинаковы, показатели ОВ имеют тенденцию к некоторому повышению у больных 2-й группы по сравнению со 1-й группой. Показатели БРВ и ОВ 1-й и 2-й групп имеют тенденцию к более высоким значениям по сравнению с соответствующими показателями больных 4-й группы. Самая низкая БРВ и ОВ наблюдались у больных 3-й группы, различия показателей статистически достоверны при их сравнении с БРВ 1-й, и с БРВ и ОВ 2-й групп (р<0,05).
12.4.1.6. Доксорубицин.
Доксорубицин в составе различных схем химиотерапии получали 57 больных РМЖ T3-4N0-2M0 и T1-2N2M0.
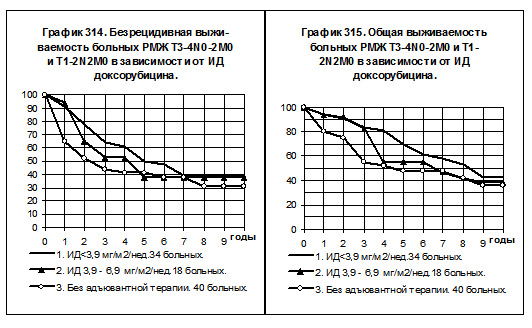
При рассчёте должной интенсивности дозы предполагалось, что больная, начиная через 2 недели после операции и получая препарат по 50 мг/м2 в 1 день курса химиотерапии с интервалом 3 недели, за 6 месяцев должна получить 4 курса химиотерапии, тогда рассчётная ИД составит 50 х 4 : 26 = 7,7 мг/м2 за неделю. В интервал с низкой интенсивностью дозы включались больные с ИД <3,9 мг/м2 за неделю, в интервал со средней ИД — больные с ИД от 3,9 до 6,9 мг/м2 за неделю и в интервал с нормальной ИД — больные с ИД >6,9 мг/м2 за неделю.
У больных РМЖ T3-4N0-2M0 и T1-2N2M0 сравнивались БРВ и ОВ в следующих группах: 1) 34 больных, получавших доксорубицин с низкой интенсивностью дозы, 2) 18 больных, получавших препарат со средней интенсивностью дозы, 3) 40 больных без адъювантной системной терапии (смотри графики 314 и 315). 5 больных, получавших препарат с нормальной интенсивностью дозы, исключены из анализа выживаемости. Показатели БРВ и ОВ больных 1-й и 2-й групп имеют тенденцию к более высоким значениям по сравнению с соответствующими показателями больных 3-й группы. БРВ и ОВ больных 1-й группы имеют тенденции к повышению по сравнению с показателями 2-й группы. Все различия статистически не значимы.
12.4.2. Сбалансированность схемы CMF.
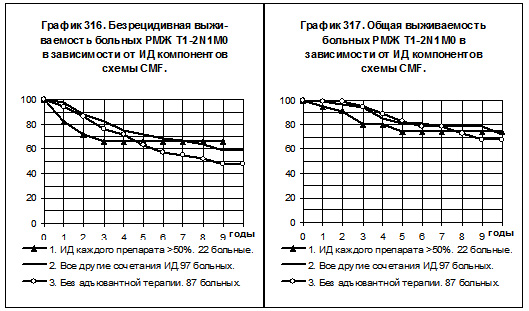
Под сбалансированной схемой CMF подразумевались те случаи проведения лечения, когда интенсивность дозы каждого из 3 препаратов превышала 50% от рассчётной интенсивности дозы, которая должна быть при химиотерапии по схеме CMF, стремящейся к её классическому варианту (циклофосфан по 100 мг/м2 1-14 дни, метотрексат по 40 мг/м2 1 и 8 дни, 5-фторурацил по 600 мг/м2 1 и 8 дни); под несбалансированной схемой — все прочие варианты сочетаний интенсивности доз циклофосфана, метотрексата и 5-фторурацила.
На графиках 316 и 317 представлено сравнение БРВ и ОВ больных РМЖ T1-2N1M0, получавших адъювантную химиотерапию по сбалансированной схеме CMF (22 больных, 1-я группа), получавших адъювантную химиотерапию по несбалансированной схеме CMF (97 больных, 2-я группа), не получавших адъювантной системной терапии (87 больных, 3-я группа). Во всех группах эндокринная терапия не проводилась. БРВ и ОВ боль-
ных 1-й группы имели тенденцию быть самыми низкими как по сравнению с показателями 2-й группы, так и по сравнению с показателями 3-й группы. БРВ и ОВ больных 2-й группы имели тенденцию к более высоким значениям по сравнению с соответствующими показателями 1-й группы и 3-й группы.
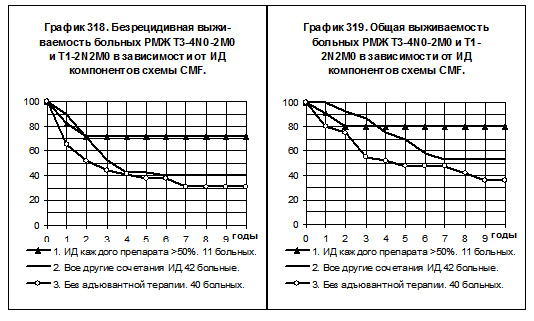
Среди больных РМЖ T3-4N0-2M0 и T1-2N2M0, число пациенток, получавших химиотерапию по сбалансированной схеме CMF составило 11 (1-я группа), число больных, получавших химиотерапию по несбалансированной схеме CMF — 42 (2-я группа), число больных, не получавших адъювантной системной терапии — 40 (3-я группа, смотри графики 318 и 319). В данном случае проведение химиотерапии по сбалансированной схеме CMF сопровождалось самыми высокими показателями БРВ и ОВ по сравнению с соответствующими показателями больных 2-й и 3-й групп, однако различия показателей статистически не значимы.
Резюме.
Нами не получено различий в результатах лечения при сравнении вариантов радикальной мастэктомии. Радикальные мастэктомии с сохранением большой грудной мышцы или обеих грудных мышц столь же эффективны, как и радикальная мастэктомия по Halsted. Что касается органосохраняющих операций, то на нашем небольшом материале получено статистически значимое ухудшение показателей БРВ больных РМЖ T1-2N0M0, перенесших секторальную резекцию с подмышечной лимфаденэктомией, по сравнению с больными, перенесшими радикальную мастэктомию в одном из её вариантов. У больных, оперированных в объёме радикальной резекции, отмечены тенденции к ухудшению показателей БРВ при РМЖ T2N0M0 и T1-2N1M0.
Одной из возможных причин, отягощающих течение болезни у больных, перенесших органосохраняющие операции, является значительно более частое обнаружение у них опухолевых клеток в лимфатических и/или кровеносных сосудах. Этот прогностически неблагоприятный признак, по-видимому, имеет ятрогенное происхождение, поскольку обнаруживается с нарастающей частотой по мере сокращения объёма иссекаемых тканей молочной железы или, другими словами, тем чаще, чем ближе к опухоли работает хирург (РМЭ — 6%, РР — 13%, СРЛЭ — 17%).
Эндокринная терапия с применением тамоксифена, производившаяся, преимущественно у больных с РЭ+ опухолями, существенно влияла на течение болезни. У больных РМЖ T1-2N0M0 его применение сопровождалось тенденциями к повышению показателей БРВ, у больных РМЖ T1-2N1M0 эндокринная терапия с применением тамоксифена приводила к статистически значимому повышению БРВ, у больных РМЖ T3-4N0-2M0 и T1-2N2M0 репродуктивного периода эндокринная терапия с применением тамоксифена приводила к статистически значимому повышению БРВ. По нашим данным эффективность адъювантной эндокринной терапии больных репродуктивного периода несколько более высока, чем больных, находящихся в менопаузе.
Анализ рассчёта интенсивности дозы показал, что при проведении адъювантной химиотерапии интенсивность дозы у большинства больных по всем преператам снижена более, чем на 50% по отношению к рассчётной интенсивности дозы.
Среди больных, получавших адъювантную монохимиотерапию тиофосфамидом, наблюдалась тенденция к повышению БРВ и ОВ в группе больных со средней ИД препарата по сравнению с больными, получавшими его с низкой ИД или не получавшими никакой адъювантной терапии. Показатели БРВ и ОВ больных двух последних групп идентичны.
ИД циклофосфана достоверно влияет на показатели БРВ и ОВ больных РМЖ T1-2N1M0, T3-4N0-2M0 и T1-2N2M0. У больных, получавших химиотерапию со средней ИД циклофосфана, показатели БРВ и ОВ были достоверно выше соответствующих показателей больных, получавших данный препарат с низкой ИД, или не получавших адъювантной системной терапии. Низкая ИД циклофосфана в различных группах сравнения приводила к незначительным тенденциям к улучшению показателей БРВ, либо вообще не приводила к малейшему позитивному изменению БРВ и ОВ.
Наблюдается тенденция к наличию прямой зависимости показателей выживаемости больных от ИД метотрексата при проведении комбинированной химиотерапии. Показатели выживаемости больных, получавших метотрексат с нормальной интенсивностью дозы, были наивысшими, далее следовали показатели выживаемости больных, получавших препарат со средней ИД. Низкая ИД метотрексата в различных группах сравнения либо вообще не приводила к минимальному повышению БРВ и ОВ, либо приводила к незначительным тенденциям к улучшению показателей БРВ.
Не наблюдалось достоверных различий между группами больных, получавших химиотерапию, включающую 5-фторурацил, в зависимости от ИД этого препарата.
Анализ ИД винкристина продемонстрировал её парадоксальное влияние на показатели выживаемости больных РМЖ T3-4N0-2M0 и T1-2N2M0. Самые низкие показатели БРВ и ОВ наблюдались у больных с нормальной дозой препарата, различия показателей статистически достоверны при их сравнении с соответствующими показателями выживаемости больных, получавших винкристин со средней и низкой дозами.
Не наблюдалось достоверных различий между группами больных РМЖ T3-4N0-2M0 и T1-2N2M0, получавших химиотерапию, включающую доксорубицин, в зависимости от ИД этого препарата.
Попытка изучения влияния сбалансированности компонентов схемы CMF по ИД не дала однозначных результатов: при РМЖ T1-2N1M0 группа больных со средней и высокой ИД каждого из препаратов имела самые низкие показатели БРВ и ОВ, а при РМЖ T3-4N0-2M0 и T1-2N2M0 — самые высокие показатели БРВ и ОВ. Все различия были статистически не значимы.