Определение местнораспространённого РМЖ в литературе противоречиво: некоторые источники называют местнораспространённым РМЖ T2N0M0, однако большинство авторов в это понятие включает рак III стадии (T3N1M0, T0-3N2-3M0 и T4N0-3M0); именно так будет рассмотрен местнораспространённый РМЖ в этой главе. Значительное число (13) сочетаний критериев T и N, включенных в III стадию и предполагащих различный прогноз, объясняет невозможность сравнения эффективности лечения в различных клиниках, т.к. результаты лечения прежде всего зависят от частоты включения в группу больных с наиболее тяжелым прогнозом, что, как правило, невоспроизводимо. В меньшей степени такая неоднородность скорости развития болезни относится к отечно-инфильтративной форме (ОИФ) РМЖ (inflammatory breast cancer), для которой характерно диффузное распространение опухоли по тканям молочной железы, отсутствие выявляемого первичного опухолевого узла и наихудший прогноз для местнораспространённого РМЖ.
Местнораспространённый РМЖ отличается от локализованного не только степенью распространённости опухоли, при этом варианте возрастает частота опухолей с неблагоприятным прогнозом и снижается частота относительно благоприятных прогностических факторов. Так, по данным РОНЦ им. Н.Н.Блохина РАМН, частота редких морфологических форм рака с относительно доброкачественным течением (слизистый, папиллярный, тубулярный и медуллярный) при раннем РМЖ (T1-2N0M0) составляет 11%, а при местнораспространенном РМЖ — 2%. Средний уровень относительного накопления в опухоли 32Р (показателя пролиферативной активности опухолевых клеток) наиболее высок у больных с поражением регионарных лимфатических узлов, оцениваемых как N2, по сравнению с больными, имевшими N1 или N0. Анеуплоидные опухоли при раннем РМЖ наблюдались в 62%, а при местнораспространенном РМЖ — в 85%, причём доля анеуплоидных многоклоновых опухолей составила 4% и 17% соответственно (Портной С.М., 1997).
K.A.Porter и N.Burstein (1996) также отмечали увеличение частоты анеуплоидных опухолей при РМЖ III стадии (77%) по сравнению с РМЖ I — II стадий (66%).
Лечение местно-распространённого РМЖ (или первично иноперабельного РМЖ) складывается из предоперационного (индукционного) лечения, местного лечения (операция или ЛТ, или сочетание ЛТ с операцией) и адъювантной терапии. Такая тактика, общепринятая в настоящее время сложилась не сразу. Исходно местно-распространённый рак с распространением на кожу и/или грудную стенку, или с поражением надключичных лимфатических узлов, или с отеком руки, был идентифицирован как иноперабельный. Здесь, прежде всего, можно сослаться на классические работы C.Haagensen: C.Haagensen и A.Stout (1943), C.Haagensen (1965). По его определению операбельность при РМЖ подразумевает не просто техническую возможность полного удаления опухоли, но возможность достижения с помощью операции стойкого местно-регионарного контроля болезни (Haagensen C., 1965). Случаи местно-распространенного РМЖ, относящиеся к IIIa стадии, формально являются первично операбельными, хотя по своим биологическим характеристикам их операбельность условна. Для этой категории пациентов предпочтительна тактика с предоперационной терапией.
15.1. Предоперационная терапия
Иноперабельные больные получали ЛТ, часть из них затем подвергалась операции. В последующем местное лечение стали дополнять проведением ХТ и ЭТ. Типичные результаты лечения представлены в таблице 1. Неудовлетворительные результаты были связаны с тем, что системную болезнь лечили местными средствами, либо системную терапию применяли в последнюю очередь.
Революционным было предложение начинать лечение местно распространённого рака как системной болезни с самых эффективных системных средств. Существенный вклад в развитие такого лечебного подхода был сделан проф. О.В.Святухиной, её учениками и последователями.
Как видно из таблицы 2 к 1975г. учениками Ольги Владимировны Святухиной были изучены при местно распространённом РМЖ эффективность предоперационной внутриартериальной химиотерапии тиофосфамидом и 5-фторурацилом (Гольдман Б.Г., 1966), предоперационной системной химиотерапии тиофосфамидом, 5-фторурацилом, сочетаниями тиофосфамид + 5-фторурацил и 5-фторурацил + циклофосфан (Гольдман Б.Г, 1975), предоперационной химиотерапии высокими разовыми дозами тиофосфамида (Викманис У.Э., 1975), особенности лечения молодых женщин с применением предоперационной химиотерапии (Полевая Е.Б., 1975).
Таблица 1. Эффективность комбинированного лечения (лучевая терапия + операция) при местно-распространённом раке молочной железы
| Автор, год публикации | n | Метод лечения |
% оперированных |
3-летняя ОВ в % |
5-летняя ОВ в % |
| С.А.Холдин и соавт., 1971 | 50181834
70 |
только операцияЛТ, операция, ХТЛТ, операция, ЭТ, ХТХТ, ЭТ, операция,
операция, ХТ |
х |
22 72 61 59 63 |
|
| А.В.Санчакова, 1972 | 207737460 | все виды леченияЛТ + операцияЛТ + операция + ЭТЛТ + операция + ЭТ + ХТ |
100 100 100 100 |
54,5±3,3 52,0±5,7 48,6±5,7 65,0±6,1 |
29,4±3,1 27,3±5,4 24,2±4,8 38,3±6,2 |
| R.Zucali и соавт., 1976 | 454 | ЛТ ± операция |
29% |
~43 |
~28 |
| В.С.Даценко 1979 | T3-4N1 | ЛТ ± операция |
х |
х |
44,2+/-3,8 |
Подтверждением правильности избранной тактики лечения являются высокие результаты 5-летней выживаемости (смотри таблицу 2), представленные по материалам РОНЦ им. Н.Н.Блохина РАМН (Шомова М.В., 1999) и НИИ Онкологии им. Н.Н.Петрова (Семиглазов В.Ф., 1999).
Таблица 2. Предоперационная химиотерапия при местно-распространённом раке молочной железы
| Автор, год публикации | n | Метод предоперационного лечения |
Эффект (полный + частичный) |
Операбельность |
3-летняя ОВ |
5-летняя ОВ |
| K.Reemstma et al., 1959 | 9 | Внутриартериальная ХТ |
1 из 9 |
х |
х |
|
| Н.Ионеску с соавт., 1963 | 721 | 150-200 мг тиофосфамида +10-20 мг триэтиленмеламина в/в + аутотрансплантация костного мозга150-200 мг тиофосфамида +10-20 мг триэтиленмеламина в/а + аутотрансплантация костного мозга |
х х |
5/7 (71%) 38% |
х х |
х х |
| Б.Г.Гольдман, 1966 | 23 | Внутриартериальная ХТтиофосфамидом или5-фторурацилом |
61%
|
83% |
х |
х |
| Б.Г.Гольдман, 1975 | 48536323 | тиофосфамид5-фторурацилтиофосфамид+5-фторурацил5-фторурацил + циклофосфан |
15 19 27 17 |
100 100 100 100 |
х х х х |
|
| Е.Б.Полевая, 1975 | больные молодого возраста | Внутриартериальная и системная ХТ, ЭТ |
50 |
100 |
46,1 |
28,9 |
| У.Э.Викманис, 1975 | 76 | тиофосфамид + ЭТ |
х |
100 |
1-год — 75% |
|
| Соколова И.Г., 1983 | 105 | CMFVP + ЭТ |
64.8 |
92.4 |
67,5* |
|
| М.В.Шомова, 1999 | 1896 | CMFVP, CMFАV, VCAF, в том числе в сочетании с ЛТ |
87 |
63,7±1,2 |
||
| В.Ф.Семиглазов, 1999 (17) | 600 | CMF, TMF, FAC, FEC + ЛТ |
~60 |
Примечание: * — среди оперированных больных
Необходимость начинать лечение местно-распространенного РМЖ с химиотерапии (ХТ) продемонстрировали A.Fourquet и соавт. (1993). Авторы сравнили эффективность двух последовательностей в проведении ХТ и лучевой терапии у 390 больных РМЖ T2-3N0-1M0. Половина больных получали 4 курса ХТ по схеме CAF, затем — местное лечение; другие 50% — сначала местное лечение, затем — ХТ. Четырехлетняя выживаемость первых составила 89%, вторых — 80% (р=0,046).
Преимущества лечения, включающего на первом этапе ХТ, представили также V.F.Semiglazov и соавт. (1994). 271 больная РМЖ IIb-IIIa стадий были рандомизированы на проведение: ХТ по схеме TMF (тиофосфамид, метотрексат, 5-фторурацил) в сочетании с лучевой терапией (1 группа, 137 пациенток) или только предоперационной лучевой терапии (2 группа, 134 пациентки). Всем была выполнена радикальная мастэктомия и проведены 4-6 курсов ХТ по схеме TMF. При морфологическом исследовании полная регрессия опухоли наблюдалась в 29% случаев 1-й группы и в 19% 2-й группы. Пятилетняя ОВ составила 86% и 78% (р>0.05), пятилетняя БРВ – 81% и 72% (р<0.05) соответственно.
Известное положение о том, что эффективность ХТ прямо коррелирует с интенсивностью дозы (ИД) химиопрепаратов при лечении диссеминированного РМЖ и при проведении адъювантной ХТ после радикальной операции, было подтверждено и в отношении предоперационной ХТ. Так, Shparik J. (1996) проведен вторичный анализ опубликованных результатов 41 исследования по предоперационной химиотерапии РМЖ. Схемы лечения включали: циклофосфан (31 исследование), 5-фторурацил (26), доксорубицин (24), эпидоксорубицин (13), метотрексат (9), винкристин (6), митоксантрон (3), цисплатин (2), митомицин С (1) и тиофосфамид (1). Выявлена прямая связь между ИД химиопрепаратов и эффективностью лечения.
На вопрос, какие схемы ХТ наиболее эффективны при предоперационном лечении, в литературе нет однозначного ответа. Большинство исследований носит поисковый характер и посвящено оценке новых противоопухолевых препаратов или применявшихся ранее во второй линии ХТ, а также повышению ИД лекарств.
Схемы CMF, VCMFP.
По данным И.Г.Соколовой (1983) предоперационная ХТ по схеме VCMFP (Cooper, один 4-недельный курс) была эффективна у 65% больных местно-распространенным РМЖ (их них в 4% больных достигнут полный эффект), 92% больных были радикально оперированы. G.Singh и соавт. (1996) отметили, что применение предоперационной ХТ по классической схеме CMF (4 курса) было эффективно у 76% больных РМЖ III стадии.
Преимущества антрациклинсодержащих схем ХТ, продемонстрированные при анализе эффективности адъювантной ХТ РМЖ по сравнению с традиционными схемами CMF и VCMFP (EBCTCG, 1998), отодвигают последние на задний план, в том числе и при проведении предоперационной ХТ.
Схемы, включающие антрациклины (FAC, FEC, AC, EC)
Наиболее часто применяются схемы, включающие антрациклины (FAC, FEC, AC, EC), значительно реже антрациклины назначаются в виде монохимиотерапии. Поддержка кроветворения гранулоцитарным колониестимулирующим фактором (Г-КСФ) или грануломоноцитарным колониестимулирующим фактором (ГМ-КСФ) позволяет увеличить ИД препаратов, что может привести к повышению эффективности ХТ.
M.Graham и соавт. (1996) при предоперационной монохимиотерапии вводили адриамицин в дозе 90 мг/м2 методом 48-часовой инфузии с интервалом 2.5 нед, Г-КСФ — в дозе 300 — 480 мкг с 4-го дня ХТ ежедневно в течение не менее 7 дней. Благодаря применению Г-КСФ ИД адриамицина превысила обычную на 40%. Клинический эффект (частичный или полный) получен у всех 47 больных.
S.Breier и соавт. (1996) проводили предоперационную ХТ 32 больным местно-распространенным РМЖ по схеме ЕС: эпирубицин 100 мг/м2 и циклофосфан 800 мг/м2 в 1-2 день с поддержкой Г-КСФ по 250 мкг/м2 на 4 — 9 день, 4 курса с периодом 15 дней. Клинический эффект отмечен у 88% пациенток, в том числе у 9% полный. Хирургическое лечение проведено 31 больной, из них 21 мастэктомия, 10 органосохраняющие операции. Полного эффекта по морфологической оценке не отмечено.
H.M.Pinedo и соавт. (1996) проводили ХТ по схеме АС: доксорубицин 90 мг/м2 и циклофосфан 1000 мг/м2 + ГМ-КСФ по 250 мкг/м2 ежедневно со 2-го по 11-й дни каждые 3 недели. После 4-6 курсов выполняли радикальную мастэктомию (РМЭ) и лучевую терапию. БРВ и ОВ были лучшими у получивших большее число курсов ХТ.
Предоперационную ХТ проводили 40 больным РМЖ T3/T4 или N2 по схеме FEC (5-фторурацил 600 мг/м2, эпирубицин 75 мг/м2, циклофосфан 600 мг/м2) с интервалом 14 дней + Г-КСФ с 3-го по 12-й дни (всего 4 курса). Прогрессирования болезни в период ХТ не наблюдалось, клинический эффект получен в 63% случаев, в том числе полный в 14%. (Artal A. et al., 1996).
H.Roche и соавт. (1997) 120 больным отечно-инфильтративной формой РМЖ проводили предоперационную ХТ по схеме FEC-HD (5-фторурацил 750 мг/м2 1-4 день, эпирубицин 35 мг/м2 2-4 день, циклофосфан 400 мг/м2 2-4 день) с добавлением (61 больная) или без добавления (59 больных) Г-КСФ. Все больные были оперированы и получали адъювантную ХТ по схеме FEC-75 (5-фторурацил 500 мг/м2, эпирубицин 75 мг/м2, циклофосфан 500 мг/м2) без Г-КСФ. В группе получавших предоперационную ХТ с включением Г-КСФ 3-летняя БРВ и ОВ (62% и 73% соответственно) были несколько выше, чем у получавших предоперационную ХТ без Г-КСФ (56% и 61% соответственно).
Проведение 2 курсов ХТ по схеме CAF (циклофосфан 400 мг/м2 1 и 8 дни, адриабластин 40 мг/м2 1 и 8 дни и 5-фторурацил 400 мг/м2 1 и 8 дни) у больных РМЖ T3N0-2M0 было эффективным в 83% случаев (Амирасланов А.Т. и др., 1997).
Fornasiero A,. и соавт., (2001) 57 больным РМЖ III стадии в качестве предоперационного лечения проводили три курса ХТ эпирубицином 100 мг/м2 1-й день, циклофосфан по 400 мг/м2 с 1-го по 3-й дни и Г-КСФ по 5 мкг/кг с 4-го по 12-й дни. Периодичность курсов 14 дней. Клинический эффект наблюдался в 93%. После РМЭ или квадрантэктомии с лучевой терапией все пациентки получали 4 курса ХТ по схеме CMF. Несмотря на низкую частоту полной морфологической ремиссии (3.5%), отдаленные результаты оказались очень хорошими, — 5-летние БРВ и ОВ 68 и 76% соответственно.
U.Coskun и соавт. (2003) описывают свой опыт проведения предоперационной ХТ 91 больной местно-распространенным РМЖ (30 — IIIa стадии, 61 — IIIb стадии). ХТ по схеме FAC или AC была эффективна в 91%, по схеме FEC или EC – в 82%, по схеме CMF – в 60 % случаев (p<0.05).
О международном кооперированном исследовании, посвященном сравнительной оценке эффективности неоадъювантной антрациклин-содержащей ХТ, проводимой в стандартных и в повышенных дозах, сообщают Therasse P, и соавт. (2003). 448 больным местно-распространенным РМЖ проводилась ХТ по одной из схем: А — циклофосфан 75 мг/м2 с 1 по 14 дни внутрь, эпирубицин 60 мг/м2 1 и 8 дни внутривенно и 5-фторурацил 500 мг/м2 1 и 8 дни 6 курсов каждые 28 дней; Б — эпирубицин 120 мг/м2 1 день, циклофосфан 830 мг/м2 1 день и Г-КСФ 5 мкг/кг подкожно со 2-го по 13-й дни 6 курсов каждые 14 дней. Среднее время до прогрессирования болезни составило 34 и 33,7 мес, 5-летняя ОВ 53 и 51% в группах А и Б соответственно. Таким образом, интенсификация дозы при ХТ по схеме ЕС не приводила к улучшению результатов лечения.
Схемы, включающие препараты платины
По данным M.Colozza и соавт. (1996), предоперационная ХТ по схеме САР (циклофосфан, доксорубицин и цисплатин) была эффективна у 77% больных РМЖ III стадии. В дальнейшем больных оперировали (модифицированная РМЭ), им проводили лучевую терапию и адъювантную ХТ по схеме CMF. Медиана БРВ составила 29 мес, ОВ — 49 мес.
L.E.Morrell и соавт. (1997) 55 больным РМЖ IIIa и IIIb стадий проводили 3-5 курсов предоперационной ХТ: 1 день — метотрексат 30 мг/м2; 2 день — винбластин 3 мг/м2, доксорубицин 30 мг/м2 и цисплатин 70 мг/м2; 15 и 22 дни — метотрексат 30 мг/м2 и винбластин 3 мг/м2. Прогрессирования на фоне ХТ не наблюдали, клинический эффект отмечен в 89% случаев, в том числе полный в 29%. Всех больных оперировали (модифицированная РМЭ), затем последовательно проводили адъювантную ХТ и лучевую терапию. Полный эффект, по данным морфологического исследования, наблюдался в 17%, ещё у 11% больных остаточная опухоль была представлена только внутрипротоковым компонентом. Пятилетняя БРВ и ОВ составили 51% и 63% соответственно.
Схемы, включающие таксаны
По данным F.U.Lara и соавт. (1997), предоперационная монохимиотерапия таксолом (паклитакселом) по 250 мг/м2 методом трёхчасовой инфузии с интервалом 21 день (всего 4 курса) позволила перевести в операбельное состояние 8 (73%) из 11 больных местно-распространенным РМЖ. Авторы считают, что в качестве ХТ первой линии таксол необходимо комбинировать с другими препаратами.
О применении таксотера (доцетаксела) сообщают W.J.Gradishar и соавт. (1997). У 30 больных РМЖ III стадии оценивали эффект предоперационной монохимиотерапии таксотером в дозе 100 мг/м2 (4 курса). Дальнейший план лечения включал операцию (лампэктомию или мастэктомию), 4 курса ХТ по схеме АС, лучевую терапию и +/- тамоксифен. Клинический эффект от предоперационной ХТ наблюдали у 83% больных, в том числе у 20% полный. По данным морфологического исследования, полный эффект отмечен в 3 % случаев.
Предоперационную монохимиотерапию 12 больным РМЖ III стадии доцетакселом с повышением ИД проводили P.A.Paciucci и соавт. (2002). Лечение состояло во введении доцетаксела в дозе 100 мг/м2 + Г-КСФ 1-6 день 4 курса с интервалом 2 недели; затем операция, 4 курса АС, лучевая терапия +/- тамоксифен. У девяти больных получен клинический эффект, у 4 (33%) из них зарегистрирована полная морфологическая резорбция опухоли, однако у 3 (25%) наблюдалось прогрессирование болезни.
В исследование L.Gianni и соавт. (1996) было включено 16 больных местно-распространенным РМЖ. Доксорубицин в дозе 60 мг/м2 вводился разовой инъекцией, паклитаксел в дозе 200 мг/м2 — в виде 3-часовой инфузии с премедикацией антигистаминными препаратами и глюкокортикоидами каждые 3 недели. Число курсов перед операцией составило 4-6. У 3 (по данным морфологического исследования у 2) больных получен полный эффект. В 69% случаев наблюдалась нейтропения IV степени.
J. Zujewski и соавт. (1996) сообщают о 9 больных местно-распространенным РМЖ, получавших ХТ доксорубицином (60 мг/м2) и циклофосфаном (2000 мг/м2); препараты вводили с интервалом 2 нед с поддержкой Г-КСФ. Затем провели 3 курса ХТ таксолом по 140 мг/м2 методом 96-часовой инфузии каждые 2 нед с поддержкой Г-КСФ. У всех больных отмечен клинический эффект, у 4 из них полный.
A.Anelli и соавт. (1997) 20 больным РМЖ IIIb стадии провели 3 курса предоперационной ХТ паклитакселом (135 — 175 мг/м2) и доксорубицином (60 мг/м2), после чего выполнили модифицированную РМЭ. По данным гистологического исследования эффект отмечен у 80% больных, в том числе у 20% полный. Отдалённые результаты пока не оценены.
Таксол в дозе 135 мг/м2 вводили методом 3-часовой инфузии в 1-й день, цисплатин (75 мг/м2 внутривенно) на 2-й день. После 3 курсов с периодичностью 3 нед больные были оперированы. Прогрессирования болезни на фоне предоперационной ХТ не наблюдали, в 90% наблюдался объективный эффект, в том числе (по данным морфологического исследования) в 20% полный (Ezzat A. et al., 1997)
von Minckwitz G. и соавт. (2001), представляют результаты предоперационной ХТ больных местно-распространенным РМЖ (размер опухоли 3 см или больше, N0-2, n=250). 4 курса ХТ проводилась каждые 14 дней: доксорубицин 50 мг/м2, доцетаксел 75 мг/м2 Г-КСФ с 5-го по 10-й дни. Клинический эффект колебался от 77.5 до 67.5% в зависимости от применения или не применения тамоксифена во время ХТ. Полный морфологический эффект наблюдался в 9.7%, еще в 2.4% остаточная опухоль была представлена только неинвазивным компонентом.
В Абердинском исследовании (Smith I.C. et al., 2002; Hutcheon A.W. et al., 2003) проводилась оценка роли доцетаксела в неоадъювантной ХТ РМЖ. 159 больных РМЖ T2-4N0-2M0 (22% — с Т4) проводилось 4 курса ХТ по схеме CVAP (циклофосфан 1000 мг/м2, винкристин 1.5 мг/м2, но не более 2 мг; доксорубицин 50 мг/м2, преднизолон 40 мг в день 5 дней) с интервалом 21 день. Больных с прогрессированием или со стабилизацией болезни (n=55, группа 1) переводили на лечение доцетакселом 100 мг/м2, 4 курса с интервалом 21 день. Больных с полным или частичным эффектом (n=104) рандомизировали на: продолжение ХТ по схеме CVAP, еще 4 курса с повышение дозы преднизолона до 100 мг в день в течение 5 дней (n=52, группа 2); ХТ доцетакселом 100 мг/м2, с аналогичной дозой преднизолона (n=52, группа 3). В 1-й группе ХТ доцетакселом была эффективна в 55%, полная морфологическая регрессия получена у 2% больных. Преимущества результатов лечения в 3-й группе по сравнению со 2-й: клиническая эффективность 85% против 64% (р=0.03), полная морфологическая регрессия 31% против 15% (р=0.06), пятилетняя БРВ 90% против 72% (р=0.04), частота выполнения органосохраняющих операций 67% против 48% (р=0.01) гранулоцитопения при проведении ХТ 46% против 69% (р=0.01).
C.Jackisch и соавт. (2002) сообщают о сравнительной оценке двух вариантов неоадъювантной ХТ 913 больных РМЖ T2-3N0-2M0. Первый вариант заключался в проведении 4 курсов ХТ доксорубицином (50 мг/м2) и доцетакселом (75 мг/м2) 1 раз в 2 недели + Г-КСФ 5 мкг/кг 5-10 дни. Во втором варианте сначала проводилось 4 курса ХТ по схеме АС, затем – 4 курса доцетакселом. При втором варианте лечения эффективность была выше, чем при первом, — 85% против 75% (р<0.001); органосохраняющие операции выполнялись чаще – 75% против 66% (р<0.005); чаще наблюдалась полная морфологическая регрессия опухоли – 14% против 7% (р<0.001). Влияние варианта ХТ на БРВ и ОВ не оценивалось.
В исследовании В-27 Национального проекта по адъювантной терапии после операций на молочной железе и толстой кишке (National Surgical Adjuvant Breast and Bowel Project, NSABBP) 2411 больных РМЖ T1-3N0-1M0 были рандомизированы на три группы: 1) проводилось 4 курса ХТ по схеме АС, операция, тамоксифен 5 лет; 2) проводилось 4 курса ХТ по схеме АС, 4 курса ХТ доцетакселом, операция, тамоксифен 5 лет; 3) проводилось 4 курса ХТ по схеме АС, операция, 4 курса ХТ доцетакселом, тамоксифен 5 лет. Оценена только эффективность предоперационного лечения. Клиническая эффективность была максимальной во второй группе – 91% по сравнению с 85% в 1-й и 3-й группах (р<0.001). Частота полной морфологической регрессии опухоли во 2-й группе – 26%, в 1-й и 3-й – 14% (р<0.001). Частота полной морфологической регрессии опухоли при применении доцетаксела возрастала как у больных с РЭ-, так и у больных с РЭ+ опухолями, однако, в целом она была выше при РЭ- опухолях (Bear H.D. et al., 2003).
E.Baltali и соавт. (2002) 63 больным местно-распространенным РМЖ (в том числе 21 больной раком IIIb стадии) перед операцией проводили лечение по схеме TEF (таксотер 80 мг/м2, эпирубицин 60 мг/м2 и 5-фторурацил 500 мг/м2), 4 курса. Затем следовали операция, 1 TEF, лучевая терапия и еще 2 TEF. Полный эффект получен в 25%, частичный эффект – в 70%, прогрессирование – в 5% случаев. Средняя БРВ была 15.9±6.8 мес., средняя ОВ – 18.6±7.2 мес. Сходное лечение (эпирубицин 75 мг/м2 и таксотер 80 мг/м2 4 курса) проводили A. de Matteis и соавт.(2003) 30 больным с опухолями >3 см или с Т4 (n=9). В 77% получен объективный эффект, в том числе полный – в 20%, полная морфологическая регрессия наблюдалась в 13% случаев.
Прочие схемы ХТ
О предварительных результатах предоперационной ХТ по схеме VEC сообщают Dohollou N. и соавт. (1996). Схема включала: винорельбин 40 мг/м2 + циклофосфан 500 мг/м2 внутривенно в 1-й день, 3 курса с интервалом 21 день, затем 3 курса винорельбина 40 мг/м2 + эпирубицина 75 мг/м2 внутривенно в 1-й день. Результат лечения оценивали у 16 больных: полный клинический эффект отмечен у 6 пациенток, частичный у 3.
Е.И.Загрекова (1997) при местно-распространенном РМЖ изучала активность некоторых схем предоперационной ХТ:
1. эпирубицин 50 мг/м2 и цисплатин 60 мг/м2 внутривенно в 1-й, 22-й и 43-й дни, фторафур 1200 мг ежедневно перорально 1-63 дни. Эффективность лечения составила 79%;
2. новантрон 10 мг/м2 и цисплатин 60 мг/м2 внутривенно 1-й, 22-й и 43-й дни, фторафур 1200 мг ежедневно перорально 1-63 дни. Эффективность лечения 70%;
3. навельбин 20 мг/м2 внутривенно в 1-й и 8-й дни, новантрон 10 мг/м2 внутривенно в 1-й день, периодичность 3 нед, эффективность 79%;
4. циклофосфан 75 мг/м2 перорально в 1-14-й дни, эпирубицин 60 мг/м2 и 5-фторурацил 500 мг/м2 внутривенно в 1-й и 8-й дни, периодичность 4 нед;
5. циклофосфан 830 мг/м2 и эпирубицн 120 мг/м2 внутривенно в 1-й день, Г-КСФ 5 мкг/кг подкожно со 2-го по 13-й день. Интервалы между курсами 2 нед.
Эффективность лечения по 4-й и 5-й схемам составила 71%, причем повышение ИД не улучшало терапевтический эффект.
Высокодозная ХТ с поддержкой кроветворения аутотрансплантацией стволовых клеток и/или костного мозга
L.Schwartzberg и соавт. (1996) в качестве предоперационной ХТ использовали 2 схемы: 1-я — адриамицин, 5-фторурацил, метотрексат (AFM) 4 курса с периодичностью 14 дней, затем циклофосфан 4 г/м2 и этопозид 600 мг/м2 (21 больная местно-распространенным РМЖ, в том числе 19 с отечно-инфильтративной формой); 2-я — 4 курса AFM+паклитаксел 200 мг/м2 2 введения с интервалом 21 день+циклофосфан 3 г/м2 (24 больные, из них 12 с отечно-инфильтративной формой). У 1 пациентки болезнь прогрессировала, остальные были оперированы (модифицированная РМЭ). При морфологическом исследовании полный эффект наблюдался у 24% больных, леченных по 1-й схеме, и у 13% леченных по 2-й. В качестве адъювантной терапии применяли высокодозную ХТ циклофосфаном, тиофосфамидом и карбоплатином, затем лучевое лечение и эндокринную терапию тамоксифеном (при РЭ+/РП+ опухолях).
Достаточно опасный вариант предоперационной ХТ описывают Dazzi C и соавт., (2001). 21 больной отечно-инфильтративной формой РМЖ проводились последовательно: 4 курса ХТ эпирубицином 150 мг/м2 с поддержкой Г-КСФ, затем 1-2 курса высокодозной ХТ митоксантроном 40 мг/м2, тиофосфамидом 500 мг/м2 и циклофосфаном 200 мг/кг. Полная морфологическая ремиссия достигнута у 4 из 19 оперированных пациенток (21%). 5 больных умерли от сердечной недостаточности, связанной с ХТ. У 8 больных наступил рецидив болезни в сроки 9-54 мес. 11 живы без рецидива болезни.
Roche H. и соавт. (2003) представляют результаты двух вариантов высокодозной ХТ больных отечно-инфильтративной формой РМЖ. Первый вариант (исследование PEGAS 02) включал ХТ из 4 предоперационных курсов:
курс 1 циклофосфан 6 г/м2 и доксорубицин 75 мг/м2;
курс 2 циклофосфан 3 г/м2 и доксорубицин 75 мг/м2;
курсы 3 и 4 циклофосфан 3 г/м2, доксорубицин 75 мг/м2 и 5-фторурацил 2,5 г/м2 с в течение 5 дней.
Далее следовали РМЭ, лучевая терапия и тамоксифен для пациенток с РЭ+ опухолями. Фебрильная нейтропения наблюдалась в 26-51% курсов ХТ. Полный морфологический эффект получен в 32% случаев. Отдаленные результаты не приводятся.
Второй вариант высокодозной ХТ (исследование PEGAS 05) состоял из 5 курсов:
курс 1 циклофосфан 6 г/м2 и доксорубицин 75 мг/м2;
курс 2 циклофосфан 3 г/м2 и доксорубицин 75 мг/м2;
курсы 3-5 доксорубицин 100 мг/м2 проводились с поддержкой только Г-КСФ с интервалом 2 нед.
Из 54 включенных в исследование больных у 8 наблюдались тяжелые инфекционные осложнения IV степени, в 2 случаях с летальным исходом. Полный морфологический эффект наблюдался в 35% случаев. Оценивают данный вариант лечения как слишком токсичный.
Химиолучевое лечение
Сочетание лучевой терапии разовой очаговой дозой 2 Гр, суммарной очаговой дозой (СОД) 50 Гр и инфузии 5-фторурацила по 200 мг/м2/сут на протяжении 8 нед (n=30) сопровождалось клиническим эффектом у 22 (73%) больных местно-распространенным РМЖ. По морфологической оценке, полный эффект был достигнут у 20% больных (Formenti S.C. et al., 1997).
В исследовании M.F.Gaui и соавт. (1997) 25 больных местно-распространенным РМЖ, резистентных к предоперационной ХТ, включающей антрациклины, получали лучевую терапию в суммарной очаговой дозе 45 Гр и ХТ цисплатином (25 мг/м2) и 5-фторурацилом (1 г/м2 — длительная инфузия) в течение 4 дней. Периодичность ХТ 28 дней, всего 2 курса. У 1 больной лечение было неэффективным, 2 больные отказались от мастэктомии и 22 пациентки были оперированы, из них у 2, по данным морфологического исследования, достигнут полный эффект.
В качестве предоперационного лечения 28 больным РМЖ II — III стадий проводили одновременно лучевую терапию СОД 50 Гр (за 5 нед) и ХТ, включающая митоксантрон 12 мг/м2 1 день, циклофосфан 500 мг/м2 1 день и 5-фторурацил 1000 мг/м2 ежедневно с 1-го по 3-й дни путем длительной инфузии. Первый курс ХТ начинали одновременно с лучевой терапией. Всего проводили от 3 до 6 курсов с периодом 3 недели. По данным морфологического исследования, 39% больных имели полный эффект от предоперационного лечения (Serin D. et al., 1997).
Последовательное применение 2 курсов ХТ по схеме CAF и химолучевой терапии (лучевая терапия расщепленным курсом СОД 60 Гр+2 курса ХТ по схеме CMF) в группе из 47 больных местно-распространенным РМЖ с самым плохим прогнозом (истинная отечно-инфильтративная форма или узловая форма с отеком более 50% поверхности кожи молочной железы, или с метастатическим поражением надключичных лимфатических узлов) имело следующую эффективность: полный эффект — 11%, частичный эффект — 72%, стабилизация — 13%, прогрессирование — 4%. Оперированы 46 пациенток. Полный морфологический эффект зарегистрирован в 9% случаев (Портной С.М. и соавт., 2000).
Эффект предоперационной ХТ
Прогнозирование эффекта
По данным V.Dieras и соавт. (1997), у больных РМЖ с высоким (более 5%) содержанием опухолевых клеток в S-фазе, эффективность предоперационной ХТ по схеме CAF была выше, чем у пациенток с их низким содержанием; увеличение ИД повышало эффективность ХТ у первых.
Высокий уровень экспрессии р53 в опухоли коррелировал с низкой эффективностью предоперационной ХТ. Корреляция клинического эффекта ХТ с экспрессией маркера her-2/neu отсутствовала. (Mangalik A. et al., 1996). В наблюдениях A.H.Tulusan и соавт. (1997) эффективность предоперационной ХТ по схеме ЕС (эпирубицин 120 мг/м2 + циклофосфан 600 мг/м2 внутривенно 1 день) зависела от экспрессии р53. Наличие р53 в опухоли сочеталось с высокой (67%) частотой резистентности к ЕС, при отсутствии р53 такая резистентность наблюдалась в 16% случаев. Корреляции между экспрессией р53 и эффективностью ХТ паклитакселом (175 мг/м2) не отмечено.
S.C.Formenti и соавт. (1996) проводили предоперационное химиолучевое лечение, включавшее длительную инфузию 5-фторурацила (200 мг/м2) и лучевую терапию в суммарной очаговой дозе 50 Гр. Экспрессия р53 в исходной первичной опухоли наблюдалась у 83% больных с отсутствием эффекта лечения и не отмечена у пациенток с частичным или полным эффектом.
A.Frassoldati и соавт. (1996) изучали в ткани РМЖ степень злокачественности, апоптотический индекс, содержание РЭ и РП, Ki67, PCNA, EGFr, erbB2, bcl-2 и p170 до и после ХТ. Связи этих показателей с эффективностью ХТ не выявлено.
По данным Д.В.Репетюка и соавт. (2003) клинический эффект предоперационной ХТ не коррелировал с гистологической формой рака, плоидностью, процентом анеуплоидных клеток и процентом р-53 позитивных клеток. У больных, имевших опухоли с низкой пролиферативной активностью или РЭ- негативные опухоли, частота клинического эффекта имела тенденцию к снижению по сравнению с больными, имевшими опухоли с высокой пролиферативной активностью или РЭ- позитивный статус. Степень патоморфоза не коррелировала с гистологической формой рака, пролиферативной активностью, процентом анеуплоидных клеток и процентом р-53 позитивных клеток. У больных, имевших диплоидные опухоли или РЭ- позитивные опухоли, наблюдалась тенденция к снижению частоты выраженного патоморфоза.
H.D.Bear и соавт. (2003) отметили большую эффективность предоперационной химиотерапии у больных с РЭ- опухолями.
Более подробно возможности прогнозирования эффекта ХТ и эффекта эндокринной терапии изложены в соответствующих главах.
Оценка эффекта
Достаточно часты ошибки в клинической оценке эффекта ХТ. Случаи, рассматриваемые клинически как полный эффект, при морфологическом исследовании нередко оцениваются иначе. По данным S.Breier и соавт. (1996), в результате предоперационной ХТ клинический эффект был достигнут в 88% случаев, в том числе в 9% полный; по морфологической оценке полного эффекта не получено.
Маммография — метод исследования, на который традиционно опираются при оценке размеров первичной опухоли, — оказался не самым лучшим для определения размеров опухоли в процессе предоперационного лечения. По наблюдениям P.Forouhi и соавт. (1994), клиническое измерение размеров и ультразвуковая томография лучше оценивают динамику размеров опухоли, чем маммография.
D.A.Mankoff и соавт. (1996) с целью разработки метода мониторинга ответа местно-распространенного РМЖ на предоперационную ХТ использовали соединение 99Тс. Измеряли накопление радионуклида в опухоли относительно нормальной ткани молочной железы исходно, после 2 мес лечения и по завершении ХТ. Средний уровень относительного накопления радионуклида в опухоли был значительно ниже при эффективном лечении, чем без такового.
М.Б.Ориновский и соавт. (1996), используя СВЧ-радиотермометрию в качестве средства контроля при проведении предоперационной лучевой терапии при местно-распространенном РМЖ, отметили, что уменьшение исходной гипертермии опухоли от 1.5-2.5 до 0.2-0.5o С коррелирует не только с уменьшением новообразования, но и с выраженностью патоморфоза в остаточной опухоли.
Г.А.Лавникова (1976) разработала морфологическую оценку выраженности повреждения опухоли при лучевой терапии. Автор выделяет 4 степени патоморфоза: I – структура опухоли сохранена, выявляется полиморфизм и дистрофия части клеток; II – очаговое исчезновение паренхимы опухоли; III – структура опухоли резко нарушена за счет фиброзного замещения или обширного некроза, или круглоклеточной инфильтрации, остатки опухоли выявляются микроскопически в виде разрозненных групп клеток с резкими дистрофическими изменениями; IV – полное исчезновение клеток паренхимы опухоли.
S.C.Formenti и соавт. (1996) предлагают следующие градации при морфологической оценке эффекта предоперационной терапии:
полный морфологический эффект — опухолевые клетки отсутствуют и в молочной железе, и в лимфатических узлах;
частичный морфологический эффект — макроскопически опухоль отсутствует, но при микроскопическом исследовании опухолевые клетки определяются в молочной железе или в лимфатических узлах;
отсутствие морфологического эффекта — опухоль определяется макроскопически.
Классификация TNM Международного противоракового союза (1997) предполагает морфологическую оценку остаточной опухоли с помощью следующих градаций показателя R (residual): R0 – остаточная опухоль отсутствует, R1 – микроскопическая остаточная опухоль, R2 — макроскопическая остаточная опухоль.
Значение выраженности эффекта
Нечувствительность к предоперационной ХТ является фактором плохого прогноза при РМЖ (Touboul E. et al., 1992; Scholl S.M. et al.,1995). По данным L.E.Morrell и соавт. (1997), именно морфологически определяемый полный эффект лечения имел значение для прогноза болезни, клинически определяемый эффект и размер остаточной опухоли существенно не влияли на прогноз.
M.Machiavelli и соавт. (1996) проводили комбинированное лечение 140 больных РМЖ IIIa и IIIb стадий: 3 курса ХТ по схеме FAC+модифицированная РМЭ. Клинический эффект наблюдался у 71% больных, стабилизация — у 26% прогрессирование — у 3%. Морфологическая оценка эффекта не совпадала с клинической. При полном эффекте, определяемом морфологически, БРВ и ОВ больных были лучше, чем при частичном эффекте или стабилизации.
J.P.Ferriere и cоавт. (1996) представили результаты лечения 329 больных РМЖ II — III стадий, которым проводили ХТ по схеме AVCF±метотрексат. Объективный эффект отмечен у 50 % больных, в том числе у 10% полный. Органосохраняющие операции выполнены 68% больных РМЖ II — IIIa стадий. Выживаемость пациенток при полном эффекте была выше, чем при других результатах ХТ.
В исследовании S.Taucher и соавт. (1997) предоперационную ХТ осуществляли по схемам CMF и FEC в объеме 2-10 (в среднем 6) курсов. В 64% случаев отмечен эффект, в том числе в 6% полный по морфологической оценке. Самым значимым фактором прогноза была выраженность эффекта предоперационной ХТ.
У больных РМЖ III стадии после предоперационной ХТ по схеме ЕС (эпирубицин 75 мг/м2+циклофосфамид 600 мг/м2, от 2 до 6 курсов с интервалом 21 день) и операции поражение регионарных лимфатических узлов имело относительное значение: БРВ и ОВ пациенток при отсутствии метастазов и поражении 1-3 лимфатических узлов различий не имели. При поражении 4 и более лимфатических узлов БРВ и ОВ пациенток были ниже (Alvarez A. et al., 1997).
Проведение предоперационной ХТ (по схемам FEC, МММ) 42 больным РМЖ T4N1M0 позволило перевести 95% больных из них в операбельное состояние. Однако послеоперационное лечение, включавшее облучение и адъювантную ХТ, было недостаточно эффективным способом предупреждения рецидива болезни. Пятилетние ОВ и БРВ составили 38% и 32% соответственно. При полном эффекте предоперационной ХТ больные живут без рецидива, степень выраженности частичного эффекта не коррелирует с БРВ (Massidda B. et al., 1996). Авторы считают необходимым исследование эффективности высокодозной ХТ с поддержкой стволовыми клетками у этой категории больных.
Д.В.Репетюк и соавт. (2003) подтверждают значимость эффекта неоадъювантной ХТ для прогноза болезни (РМЖ II-III стадий). Появление отдалённых метастазов в первые 2 года наблюдалось у 4% больных, леченных с эффектом, у 38% больных, леченных со стабилизацией и у 100% больных, имевших прогрессирование опухоли.
15.2. Хирургическое лечение
Целесообразность хирургического лечения при местно-распространенном РМЖ оспаривается F.Baillet и соавт. (1992). Больных местно-распространенным РМЖ (n=134, в том числе 108 с T3 и 27 с Т4) лечили с применением предоперационной ХТ (винбластин 6 мг/м2, тиофосфамид 6 мг/м2, метотрексат 25 мг/м2, 5-фторурацил 350 мг/м2 и адриамицин 30 мг/м2 внутривенно каждые 10 дней в течение 2 мес), лучевой терапии (наружное облучение 23 Гр за 4 фракции+внутритканевая терапия с использованием 192Ir в дозе 20-30 Гр). Адъювантную ХТ осуществляли по прежней схеме на протяжении 12-18 мес (введение адриамицина прекращали по достижении суммарной дозы 400 мг/м2). Операцию производили только в случаях местно-регионарного рецидива. Пяти- и десятилетняя выживаемость составила 64 и 50% соответственно. Местно-регионарный рецидив наблюдался у 20% больных. Считают, что все другие сочетания лечебных методов, включающие операцию, дают худшие результаты.
Другие попытки избежать операции были менее удачны. D.B.McLaren и соавт. (1995) провели ретроспективный анализ результатов лечения 91 больной местно-распространенным РМЖ, из которых 2/3 имели Т4 и/или поражение лимфатических узлов. Предоперационная ХТ (по различным схемам) была эффективна в 61% случаев, дополнительная лучевая терапия повышала частоту эффекта до 93% (в том числе 56% случаев полного эффекта), однако мастэктомия была выполнена только 31% пациенток. Пяти- и десятилетняя БРВ составили 18% и 8%, пяти- и десятилетняя ОВ — 28% и 11% соответственно. Возврат болезни в 31% случаев проявлялся развитием местного рецидива и в 15% — одновременным развитием местного рецидива и отдалённых метастазов. M.Buric и соавт. (1996) приводят результаты консервативного лечения 30 больных РМЖ отёчно-инфильтративной формы. Лечение включало 3 курса ХТ по схеме FAC (циклофосфан 500 мг/м2 + адриамицин 50 мг/м2 + 5-фторурацил 500 мг/м2) с интервалом 4 недели, затем лучевую терапию и ещё 3 курса ХТ по схеме FAC. Через 1-32 месяца у 22 (73%) пациенток наблюдалось местное прогрессирование болезни, отдалённые метастазы были первым проявлением диссеминации у 7 больных.
Проблема оценки операбельности местно-распространённого (или первично неоперабельного) РМЖ относится только к больным, имеющим в результате предоперационного лечения частичный эффект или эффект в виде стабилизации болезни. Больные с прогрессированием болезни остаются иноперабельными, операция возможна только с паллиативной целью (например, при распаде опухоли), но не с целью достижения ремиссии. Больные, леченные с полным эффектом, безусловно, операбельны, решение о целесообразности операции у них основано на сомнении в точности оценки полноты эффекта.
Правильное определение операбельности позволяет оптимизировать лечение за счёт отказа от операций, сопровождающихся быстрым местно-регионарным возвратом болезни, в пользу модификации и интенсификации консервативного лечения. Как известно, понятие операбельности при РМЖ подразумевает не просто техническую возможность полного удаления опухоли, но и возможность достижения с помощью операции стойкого местно-регионарного контроля болезни (C.Haagensen, 1965).
Плоидность опухолевых клеток, доля клеток в S-фазе, уровень РЭ не имеют дополнительного значения для прогнозирования местно-регионарного рецидива болезни (Ewers S.B. et al., 1992).
Относительное накопление 32Р в остаточной опухоли несет прогностическую информацию, позволяющую определять операбельность местно-распространённого РМЖ (Портной С.М., 1997). Относительное накопление 32Р в остаточной опухоли после проведения предоперационной терапии определено у 40 больных РМЖ III стадии. Во всех случаях имели место частичный эффект лечения или стабилизация процесса, больные были оперированы и получали адъювантную системную терапию. Двухлетняя выживаемость больных без местно-регионарного рецидива при низком накоплении 32Р в остаточной опухоли составила 96%, при высоком — 31% (р<0,02).
Возможность органосохраняющих операций при местно-распространённого РМЖ, за исключением случаев, относящихся к Т4, в большинстве современных публикаций оценивается весьма оптимистично. По данным G.Calais и соавт. (1993), у больных РМЖ Т2 — Т3 и размером опухоли более 3 см предоперационная ХТ даёт возможность осуществлять органосохраняющую операцию в 43%случаев, по данным G.F.Schwartz и соавт. (1995), — в 85%.
В наблюдении U.Veronesi и соавт. (1995) у 90% больных при размере опухоли более 3 см предоперационная ХТ приводила к ее существенному уменьшению, позволяющему выполнить квадрантэктомию. Местный рецидив после квадрантэктомии наблюдался в 6%, а после мастэктомии — в 22% случаев, что, скорее всего, отражало исходное биологическое различие опухолей, чувствительных и резистентных к ХТ. Авторы отмечают, что выполнение органосохраняющих операций после ХТ имеет ряд особенностей. С целью точной идентификации остаточной опухоли рекомендуют маркировать её исходную локализацию с помощью кожной татуировки. Необходимо иссекать все участки ткани, имеющие микрокальцинаты. Морфологическое исследование должно включать микроскопическую оценку состояния краёв иссекаемой ткани молочной железы.
Н.А.Огнерубов и соавт. (1997) оптимистично относятся к выполнению органосохраняющих операций при местно-распространённом РМЖ после эффективной ХТ.
S.Taucher и соавт. (1997), анализируя результаты предоперационной ХТ при местно-распространённом РМЖ по схемам CMF и FEC, пришли к выводу, что в 70% случаев при РМЖ Т3-Т4 возможны органосохраняющие операции.
S.Barni и соавт. (1997) применяли эпидоксорубицин в качестве предоперационной монохимиотерапии. Больным РМЖ II-IIIa стадии (n=100), препарат вводили по 120 мг/м2 внутривенно 3 раза через 21 день. Органосохраняющую операцию выполнили 71 больной, РМЭ — 29. При средней длительности наблюдения 36 месяцев местный рецидив после органосохраняющей операции развился у 8% больных.
Больным местно-распространённым РМЖ (n=152) – авторы имели в виду размер первичной опухоли более 3 см — проводилиь 3-4 курса предоперационной ХТ эпирубицином и циклофосфаном. Лечение было эффективным в 78% случаев, органосохраняющие операции выполнены 69% больных. Повторные резекции пришлось выполнять в 6 раз, а вторичные мастэктомии — в 7 раз чаще, чем при лечении раннего РМЖ, из-за трудностей в оценке объёма удаляемых тканей (Wallwiener D. et al., 1997).
M.Zambetti и соавт. (1997) 88 больным местно-распространённым РМЖ в качестве предоперационного лечения проводили ХТ доксорубицином (n=47) или эпидоксорубицином (n=41) по 3 курса с достижением клинического эффекта в 70% случаев. Были оперированы 84 пациентки: 56 выполнена модифицированная РМЭ, 28 — квадрантэктомия. Квадрантэктомию применяли при небольшом размере остаточной опухоли и отсутствии признаков местного распространения и мультицентричности. После операции больные получали адъювантную ХТ по схеме СMF (6 курсов) и лучевую терапию. Четырёхлетняя БРВ больных этой группы составила 50%, больных, имевших N2 и/или отек кожи, занимающий более 1/3 поверхности молочной железы, — 38%. Частота местного рецидива как первого проявления возврата болезни составила 6% при обеих операциях. Считают, что в отдельных случаях органосохраняющие операции можно выполнять без повышения риска местного рецидива.
По нашим данным выполнение органосохраняющих операций у 19 больных (РМЖ T2-3N0-2M0, предоперационная ХТ, остаточная опухоль до 2 см, послеоперационная лучевая терапия) не сопровождалось местными рецидивами при средней длительности прослеженности 29 месяцев (Портной С.М. с соавт., 2003).
В абсолютном большинстве современных публикаций, посвященных выполнению вариантов РМЭ, описана модифицированная РМЭ, при которой сохраняется большая грудная мышца (Patey и Disson) или обе грудные мышцы и удаляются лимфатические узлы I, II и III уровней (Летягин В.П. и Высоцкая И.В. 1996; Colozza M. et al., 1996; Schwartzberg L. et al., 1996; Morrell L.E. et al., 1997).
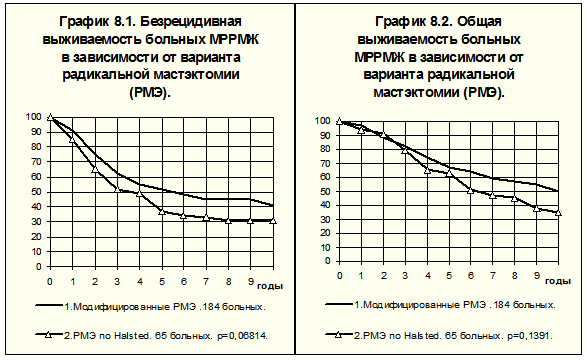
По данным РОНЦ им. Н.Н.Блохина РАМН, при раке III стадии РМЭ по Halsted не имеет преимуществ перед модифицированными РМЭ (рис.1).
Показания к РМЭ по Halsted точно определены в работе M.P.Osborne и соавт. (1990): при прямом распространении опухоли на большую грудную мышцу, поражении лимфатических узлов Роттера (по задней поверхности большой грудной мышцы) и при выполнении паллиативных операций.
Одномоментное выполнение первичной реконструкции молочной железы при местно-распространённом РМЖ вполне оправдано, т.к. позволяет удалять больший объем тканей, что повышает радикальность операции и улучшает психологическое состояние пациенток (Блохин С.Н. и др., 1994; Сидоров С.В. и др., 1997; Blokhin S.N. et al., 1996; Chin P.L., et al., 2000). По данным С.Н.Блохина и соавт. (1994), С.Н.Блохина (2002), S.Portnoj и соавт. (2004) первичная реконструкция молочной железы поперечным ректоабдоминальным лоскутом не мешает проведению пред- и послеоперационной лучевой терапии, предоперационной и адъювантной ХТ.
15.3. Адъювантная терапия
Необходимость системной терапии подтверждает H.Rainer (1993) в сравнительном исследовании двух стратегий лечения больных местно-распространённым РМЖ. Первая предполагала проведение предоперационной ХТ, операции и послеоперационной ХТ с последующей эндокринной терапией тамоксифеном; вторая — предоперационную лучевую терапию, операцию и послеоперационную лучевую терапию. Продемонстрированы значительные преимущества первой стратегии по показателям БРВ и ОВ.
Jaiyesimi I.A. и соавт. (1997) анализировали результаты лечения РМЖ II-III стадий у 215 больных с поражением 10 и более лимфатических узлов. Адъювантную ХТ получали 102 больные, тамоксифен — 39, ХТ+тамоксифен — 49, не получали системной терапии 24 пациентки. Пяти- и десятилетняя БРВ составили 32 и 23%, ОВ — 42 и 22% соответственно. Самым сильным фактором, влияющим на появление рецидива болезни и приводящим к смерти, было отсутствие системной терапии.
Эндокринная адъювантная терапия местнораспространенного РМЖ обычно проводится по завершении адъювантной ХТ. Принципы проведения эндокринной адъювантной терапии не отличаются от таковых, разработанных для первично операбельного РМЖ (смотри главу 14).
Адъювантная ХТ без дополнительных средств интенсификации дозы
Несмотря на высокую эффективность предоперационного лечения, проведение операции, лучевой терапии и адъювантной ХТ по схеме CMF, отдалённые результаты лечения РМЖ III стадии могут оказаться невысокими с медианой БРВ 29 мес, ОВ — 49 мес. (Colozza M. et al.,1996).
По данным D.A.Fein и соавт. (1994), адъювантная ХТ, включающая доксорубицин, была столь же эффективна, как ХТ по схеме CMF. Аналогичные результаты были получены при ретроспективном сравнении эффективности ХТ по схемам CMF и VAM — винкристин, адриамицин, метотрексат (Шомова М.В. и др., 1997; Letyagin V. et al., 1997).
Противоположные результаты о роли доксорубицина в адъювантной ХТ РМЖ получили В.Ф.Семиглазов и соавт. (1992), V.F.Semiglazov и O.M.Golubeva (1995). В рандомизированном исследовании проводили сравнение больных РМЖ T3N0-2M0, получавших предоперационно лучевую терапию СОД 60 Гр, перенесших операцию и адъювантную терапию адриабластином по 50 мг/м2, 1-й и 8-й дни, 5 курсов с периодичностью 4 нед; или 6 курсов по схеме CMF. Пятилетняя БРВ при первом варианте адъювантной терапии составила 54%, при втором — 44% (р<0,05), 5-летняя ОВ 62 и 55% соответственно (различия статистически не значимы). При сравнении результатов лечения больных РМЖ только IIIа стадии, различия ОВ также становятся статистически значимыми (Семиглазов В.Ф. и соавт., 2000).
В рандомизированном исследовании E.Gallioni и соавт. (1997) у больных репродуктивного возраста при РМЖ II-III стадий с поражением более 3 лимфатических узлов сопоставляли эффективность адъювантной ХТ по схемам CMF и ЕС. ХТ по классической схеме CMF включала 6 курсов, повторявшихся каждые 28 дней: циклофосфан 100 мг/м2 перорально, 1- 14 дни, метотрексат 40 мг/м2 1 и 8 дни, 5-фторурацил 600 мг/м2 1-й и 8-й дни. ХТ по схеме ЕС состояла из введения эпирубицина (120 мг/м2) и циклофосфана (600 мг/м2) в 1-й день с интервалами 21 день, всего 4 курса. Трёхлетняя БРВ больных, леченных по схеме ЕС, была несколько выше (72%) таковой у получавших ХТ по схеме СMF (63%, различия статистически незначимы).
B.Massidda и соавт. (1996) считают необходимым исследование эффективности у больных РМЖ T4N1M0 высокодозной ХТ с поддержкой стволовыми клетками, поскольку традиционная ХТ, имевшая успех в качестве предоперационной и повторяющаяся после операции в качестве адъювантной, дает лишь 32% пятилетней БРВ.
По данным РОНЦ им. Н.Н.Блохина РАМН, больным местно-распространённым РМЖ, леченным до 1994 г., адъювантную ХТ по схеме CMF в адекватных дозах проводили менее чем в половине случаев. Адекватность дозы оценивали с помощью расчета ИД химиопрепаратов, полученных пациентом за 6 мес после операции в мг/м2 за неделю. Больные были распределены на группы получивших нормальную, среднюю и низкую ИД. Нормальной считалась ИД препарата больше 90%, средней – 50-90%, низкой — менее 50% от должной.
На рис. 2 представлены показатели БРВ и ОВ больных местно-распространённым РМЖ в зависимости от ИД циклофосфана: низкой (меньше 135 мг/м2/нед, 1-я группа, n=77) и средней (135-242 мг/м2/нед, 2-я группа, n=45), группу сравнения (3-ю группу, n=40) составили пациентки, не получавшие адъювантной системной терапии. Циклофосфан с нормальной ИД (больше 242 мг/м2/нед) получили только 3 больных. БРВ больных 1-й и 3-й групп практически одинакова, ОВ в 1-й группе несколько выше, чем в 3-й. Самые высокие БРВ и ОВ больных отмечены во 2-й группе, различия показателей статистически достоверны при сравнении с 1-й и 3-й группами (р<0,05).
Влияние ИД метотрексата на отдалённые результаты лечения представлено на рис. 3. Анализировали БРВ и ОВ пациенток в трех группах: 1-я — 67 больных, получавших метотрексат низкой (меньше 4.8 мг/м2/нед) ИД; 2-я — 40 больных, получавших препарат средней (4.8-8.6 мг/м2/нед) ИД; 3-я — 40 больных без адъювантной системной терапии. Метотрексат нормальной (больше 8.6 мг/м2/нед) получали только 4 пациентки. БРВ и ОВ больных 1-й группы несколько выше таковых в 3-й группе. Самые высокие показатели БРВ и ОВ отмечены во 2-й группе, различия ОВ статистически достоверны по сравнению с 3-й группой (р=0.04253).
Сравнительная оценка отдаленных результатов лечения местно-распространенного РМЖ в зависимости от ИД 5-фторурацила проведена в трех группах: 1-я — 60 больных, получавших 5-фторурацил низкой (меньше 116 мг/м2/нед) ИД; 2-я — 49 получавших препарат средней (116-208 мг/м2/нед) ИД; 3-я — 40 пациенток без адъювантной системной терапии (рис. 4). Нормальной (более 208 мг/м2/нед) ИД 5-фторурацил получили только 3 больные, которые не включены в анализ выживаемости. БРВ больных 1-й группы несколько выше, чем в 3-й; различие показателей ОВ между этими группами статистически значимо (р=0.02349). Различия БРВ и ОВ между 1-й и 2-й группами незначительны и статистически незначимы.
M.Janvier и соавт. (1997) показали целесообразность дополнительной отсроченной адъювантной ХТ. Больные с отёчно-инфильтративной формой РМЖ (n=138) получали первичное лечение в виде 3 курсов ХТ по схеме AVCMF (адриамицин 50 мг/м2 в 1-й день, винкристин 0.7мг/м2 во 2-й день, циклофосфан 300 мг/м2 2-3 дни, метотрексат 15 мг/м2 2-3 дни, 5-фторурацил 450 мг/м2 2-3 дни); курсы повторялись каждые 28 дней. Местное лечение состояло в облучении (у большинства больных), сочетании облучения с операцией или только в операции. Больных, находившихся в ремиссии 3 года, рандомизировали на 2 группы: А — получавших 6 курсов VM (этопозид 120 мг/м2 перорально 1-3 дни и митомицин 8 мг/м2 внутривенно 1-й день) и Б — не получавших дополнительной ХТ. В группе А отмечено статистически значимое повышение БРВ по сравнению с группой Б.
Повышение ИД с помощью Г-КСФ
M.Graham и соавт. (1996) продемонстрировали возможности повышения ИД при проведении адъювантной ХТ больных местно-распространенным РМЖ. Общая схема лечения — 4 курса ХТ адриамицином+операция+4 CMF+облучение с добавлением тамоксифена при гормонально зависимых опухолях; CMF (однодневный) с дозами 900-1350/ 60-90/ 900-1350 мг/м2+Г-КСФ в дозе 300-480 мкг с 3-го дня ежедневно не менее 7 дней. ИД адриамицина превысила обычную на 40%, при CMF — на 140%. Стоимость Г-КСФ составляла 9 000-14 400 долларов США.
В исследовании Fumoleau P. и соавт. (1997, 2001) проводилось рандомизированное сравнение двух вариантов профилактического лечения пациенток с поражением 10 и более лимфатических узлов (n=150). Одна половина больных получала стандартную ХТ по схеме АС (доксорубицин 60 мг/м2 и циклофосфан 600 мг/м2) 4 курса с интервалом 3 недели (группа А); второй половине проводилась интенсивная ХТ митоксантроном 23 мг/м2 и циклофосфаном 600 мг/м2 с поддержкой Г-КСФ 5 мкг/кг со 2-го по 15-й дни с интервалом 3 нед (группа Б). 5-летняя БРВ в группах А и Б составила 41 и 49%, ОВ — 61% и 60% соответственно. Раздельный анализ для группы больных с поражением 15 и более лимфатических узлов показал преимущества 5-летней выживаемости без отдаленных метастазов в группе Б (49%) по сравнению с группой А (19%, р=0.01).
Несколько более жесткий режим ХТ предлагают Perez-Gracia J.L. и соавт. (2001) для дальнейшего исследования в качестве альтернативы высокодозной ХТ с трансплантацией костного мозга или клеток-предшественников кроветворения. Два курса ХТ с интервалом 4 нед митоксантроном 25 мг/м2 и циклофосфаном 4000 мг/м2 проводились после ХТ с обычными дозами препаратов. Пациенты получали Г-КСФ и ципрофлоксацин до восстановления кроветворения. Лечение не сопровождалось тяжелыми осложнениями.
Fountzilas G. и соавт. (2001) больным с поражением 10 и более лимфатических узлов (n=49) планировали 9 курсов адъювантной ХТ: 3 курса эпирубицином (110 мг/м2), 3 курса паклитакселом (250 мг/м2) и три курса по «интенсивной» схеме CMF (циклофосфан 840 мг/м2, метотрексат 57 мг/м2, 5-фторурацил 840 мг/м2). Все курсы повторялись с интервалом 2 нед и поддерживались Г-КСФ. 96% пациенток получили все 9 курсов ХТ, из которых 80% были проведены в полных дозах. 3-летняя БРВ составила 72%, ОВ — 90%.
Риск развития острого миелолейкоза и миелодиспластического синдрома, обусловленных проведением лечения, оценен Smith RE. (2003) на опыте 6 завершенных исследований по адъювантной ХТ Национального проекта по адъювантной терапии после операций на молочной железе и толстой кишке (National Surgical Adjuvant Breast and Bowel Project, NSABBP). Относительный риск развития этих болезней значительно повышался (в 6.16; P<0.0001) у больных, получавших более интенсивные режимы, по сравнению со стандартным АС. Риск коррелировал в большей степени с ИД препаратов, а не с их кумулятивной дозой. Доза Г-КСФ также независимо коррелировала с повышением риска развития острого миелолейкоза и миелодиспластического синдрома. Вероятность развития этих болезней также была более высокой (в 2.38; P=0.006) у больных, получавших лучевую терапию, чем у не получавших.
Высокодозная ХТ с аутотрансплантацией стволовых клеток и/или костного мозга
T.R.Klumpp и соавт. (1996) 28 больным РМЖ IIb — III стадий проводили адъювантную ХТ циклофосфаном (6 г/м2), этопозидом (2,4 г/м2) и карбоплатином (1,2 г/м2) с поддержкой в виде аутотрансплантации стволовых клеток и, у половины больных — костного мозга. Одна больная умерла от веноокклюзивной болезни печени.
В исследовании E.J.Th.Rutgers и соавт. (1996) больные РМЖ II-III стадий с поражением лимфатических узлов получали перед операцией 3 курса ХТ по схеме FEC. Даже при минимальном клиническом эффекте пациентки были оперированы; дальнейшее лечение определяли методом рандомизации. Больным 1-й группы проводили четвёртый курс ХТ по схеме FEC, облучение и эндокринную терапию тамоксифеном на протяжении 2 лет. Во 2-й группе к аналогичному лечению после FEC добавлялся курс высокодозной ХТ (циклофосфан 6 г/м2, тиофосфамид 480 мг/м2 и карбоплатин 1600 мг/м2) с трансплантацией предварительно собранных из периферической крови стволовых клеток. Четырёхлетняя БРВ в 1-й группе (n=38) составила 75%, во 2-й (n=41) — 80% (различия статистически незначимы).
Больные РМЖ отёчно-инфильтративной формы (n=28) получали 4 курса ХТ по схеме FEC (5-фторурацил, эпирубицин и циклофосфан), далее им выполняли РМЭ с одновременным забором костного мозга, а через 1 мес — высокодозную ХТ (CDDP 40 мг/м2 1-4-й дни, вепезид 400 мг/м2 1-4-й дни и циклофосфан 1500 мг/м2 1-3-й дни) с трансплантацией костного мозга; завершали лечение облучением. Показатели 3-летней ОВ и БРВ составили 78 и 60% соответственно (Roche H. et al., 1996).
В исследовании G.Somlo и соавт. (1996) у 93 больных РМЖ IIb стадии с поражением 10 и более лимфатических узлов (n=40), IIIa стадии (n=36) и IIIb стадии (n=17) адъювантное лечение включало высокодозную ХТ этопозидом (60 мг/кг), циклофосфаном (100 мг/кг) и или доксорубицином (165 мг/м2), или цисплатином 250 мг/м2) с последующей аутотрансплантацией стволовых клеток. Четырехлетняя БРВ и ОВ больных РМЖ IIb стадии составили 62 и 85%, IIIa стадии — 56 и 69% и IIIb стадии – 35 и 51% соответственно. Высокодозная ХТ не изменила влияние других факторов прогноза на течение болезни.
J.D.Bitran и соавт. (1996) сообщают о 25 больных РМЖ II и IIIa стадий с поражением более 10 лимфатических узлов, которые получали адъювантную ХТ, включавшую 4 курса по схеме FAC и курс высокодозной ХТ циклофосфаном (2,5 г/м2) и тиофосфамидом (225 мг/м2) в 1-, 3- и 5-й дни с трансплантацией аутологичного костного мозга (n=7) или стволовых клеток (n=18). Тридцатимесячная БРВ составила 80%. Стоимость высокодозной ХТ с трансплантацией костного мозга или стволовых клеток и последующим наблюдением больных в стационаре колебалась от 48 524 $ до 127 411 $.
В исследование W.Peters и соавт. (1999) были включены больные РМЖ IIb-IIIa стадий, имевших поражение 10 и более лимфатических узлов. В качестве адъювантной ХТ больные получали 4 курса по схеме CAF (1200/60/600 мг/м2 каждые 28 дней), затем проводилась рандомизация на: А (n=394) — получавших высокодозную ХТ циклофосфаном (5625 мг/м2), цисплатином (165 мг/м2) и BCNU (600 мг/м2); Б (n=389) — получавших промежуточные дозы тех же препаратов (циклофосфана 900 мг/м2, цисплатина 90 мг/м2 и BCNU 90 мг/м2) с поддержкой Г-КСФ. Затем всем больным проводили местно-регионарное облучение, больным с рецепторопозитивными опухолями предписывали прием тамоксифена на протяжении 5 лет, в случаях рецидива болезни больным группы Б проводили высокодозную ХТ. В группе А рецидив болезни наблюдался у 78 больных, в группе Б у 107. Осложнения со смертельным исходом имели место в 29 случаях в групп А, в группе Б их не было. При средней длительности наблюдения 37 мес БРВ составила 68 и 64%, ОВ — 78 и 80% соответственно. Признано необходимым продолжить исследования.
Скандинавская группа по изучению РМЖ (The Scandinavian Breast Cancer Study Group, 1999) представила результаты исследования, в которое были включены 525 больных, имевших риск рецидива болезни за 5-летний период после операции 70% и более. Рандомизация проводилась между:
контрольной группой (А) — 9 курсов ХТ по схеме FEC (5-фторурацил 300-600 мг/м2, эпирубицин 38-120 мг/м2, циклофосфан 450-1800 мг/м2; при хорошей переносимости исходные невысокие дозы возрастали);
группой (Б) получивших 2 курса ХТ по схеме FEC в стандартных дозировках и третий курс в дозах 5-фторурацила 600 мг/м2, эпирубицина 60 мг/м2, циклофосфана 1200 мг/м2; после сепарации стволовых клеток проводили высокодозную ХТ циклофосфаном (6 г/м2), тиофосфамидом (0,5 г/м2) и карбоплатином (0,8 г/м2).
В анализ были включены 274 больные, получавшие местно-регионарное облучение и тамоксифен по 20 мг в сутки при ЭР+ -опухолях. При средней длительности наблюдений 23.7 мес ОВ в сравниваемых группах составила около 80%, умерли 47 больных в группе А и 54 в группе Б, рецидив болезни развился у 66 и 92 больных соответственно.
Данные по рандомизированным исследованиям, изучавших эффективность адъювантной высокодозной ХТ у больных первично операбельным РМЖ (IIb-IIIа стадий), приведены в таблице 3.
Таблица 3. Результаты рандомизированных исследований по высокодозной адъювантной ХТ РМЖ.
| Источник литературы | Характеристика больных | n | Вид адъювантной ХТ | БРВ | ОВ |
| RutgersE.J.Th. и соавт. (1996) | IIb-III стадия с поражением ЛУ | 79 | 4 FEC | 4-летняя 75% | |
| 4 FEC + циклофосфан 6 г/м2, тиофосфамид 480 мг/м2 и карбоплатин 1,6 г/м2 | 4-летняя 80%* | ||||
| W.Peters и соавт. (1999) | IIb-IIIa стадия с поражением 10 и более ЛУ. |
7834 CAF+ циклофосфан 900 мг/м2, цисплатин 90 мг/м2 и BCNU 90 мг/м264% (при средней длительности наблюдений 37 мес)80% (при средней длительности наблюдений 37 мес)4 CAF+ циклофосфан 5625 мг/м2, цисплатин 165 мг/м2 и BCNU 600 мг/м268%* (при средней длительности наблюдений 37 мес)78%* (при средней длительности наблюдений 37 мес)The Scandinavian Breast Cancer Study Group, 1999;
Bergh J. et al, 2000Риск рецидива болезни за 5-летний период после операции 70% и более.5259 FEC3-летняя 72%3-летняя 83%3 FEC+ циклофосфан 6 г/м2, тиофосфамид 0,5 г/м2 и карбоплатин 0,8 г/м23-летняя 63%*3-летняя 77%*Roche H. et al., 2003IIb-IIIa стадия с поражением более 7 лимфатических узлов3144 FEC3-летняя 55%3-летняя 84%4 FEC+ циклофосфан 120 мг/кг, митоксантрон 45 мг/м2 и мелфалан (алкеран) 140 мг/м23-летняя 71% (Р=0.002)3-летняя 85%* Tallman MS, et al., 2003IIb-IIIa стадия с поражением 10 и более лимфатических узлов5406 CAF**6 CAF+высокие дозы циклофосфана и тиофосфамидаRodenhuis S, et al., 2003IIb-IIIa стадия с поражением 4 и более лимфатических узлов8855 FEC 5-летняя 59% 4 FEC+ циклофосфан 6 г/м2, тиофосфамид 480 мг/м2 и карбоплатин 1,6 г/м25-летняя 65%* В том числе с поражением 10 и более лимфатических узлов 5 FEC5-летняя 51% 4 FEC+ циклофосфан 6 г/м2, тиофосфамид 480 мг/м2 и карбоплатин 1,6 г/м25-летняя 61% Р=0.05
Примечания: * — статистически значимые различия отсутствуют,
ЛУ – лимфатические узлы.
Из приведенных результатов можно сделать следующий вывод: повышение дозы химиопрепаратов при высокодозной ХТ не имеет абсолютного значения для преодоления химиорезистентности опухолевых клеток.
Bou-Khalil J. и соавт. (2003) у больных местно-распространенным РМЖ после эффективной неоадъювантной ХТ и операции при наличии 4 и более пораженных лимфатических узлов оценивают вероятность рецидива болезни как очень высокую, среднее время, за которое развивается рецидив, составляет 18 мес. Пациенткам такой категории (n=14, 79% из них имели IIIb стадию РМЖ) проводили два курса высокодозной ХТ с поддержкой клетками-предшественниками кровотворения. Первый курс – мелфаланом 140 мг/м2, второй – тиофосфамидом 900 мг/м2. Средняя длительность прослеженности 26,5 мес, за это время у половины пациенток развился рецидив болезни. БРВ несколько улучшилась по сравнению с больными, получавшими стандартную адъювантную ХТ.
Проведение высокодозной ХТ в качестве адъювантного лечения при первично иноперабельном РМЖ подразумевает определенную селекцию пациентов, т.к. при отсутствии эффекта от предоперационной ХТ, больным не проводятся операция и адъювантное лечение. Таким образом, на высокодозную адъювантную ХТ не попадают больные с крайними проявлениями лекарственной устойчивости. Так было построено лечение в группе из 65 больных местно-распространенным РМЖ с самым плохим прогнозом (истинная отечно-инфильтративная форма или узловая форма с отеком более 50% поверхности кожи молочной железы, или с метастатическим поражением надключичных лимфатических узлов). Перед операцией проводились 2 курса ХТ по схеме CAF, лучевая терапия в дозе 60-70 Гр в сочетании с двумя курсами ХТ по схеме CMF. После операции проводилась адъювантная ХТ в одном из двух вариантов: 6 курсов по схеме FAC (группа А, n=56); либо 2-3 курса по схеме FAC и курс высокодозной ХТ (циклофосфан 6 г/м2, тиофосфамид 700 мг/м2 и карбоплатин 1200 мг/м2) с трансплантацией предварительно собранных из периферической крови стволовых клеток (группа Б, n=9). Пятилетняя БРВ в группе А — 37, в группе Б – 76% (p>0.05). Полученные данные могут свидетельствовать о перспективности дальнейшего изучения эффективности высокодозной ХТ в качестве адъювантного лечения местно-распространенного РМЖ (Мистакопуло М.Г. и др., 2003).
Лучевая терапия
Относительно времени применения лучевой терапии в лечении местно-распространенного РМЖ существуют различные мнения. Согласно новой тенденции лучевую терапию проводят после операции и после адъювантной ХТ (Graham M. et al., 1996; Pinedo H.M. et al., 1996; Roche H. et al., 1996; Gradishar W.J. et al., 1997).
L.Schwartzberg и соавт. (1996), L.E.Morrell и соавт. (1997), M.Colozza и соавт. (1996) проводят лучевую терапию после операции, перед адъювантной ХТ; а V.F.Semiglazov и O.M.Golubeva (1995), J.Yau и соавт. (1996) — перед операцией. Наконец, некоторые авторы предпочитают проводить лучевую терапию одновременно с предоперационной ХТ (Letyagin V. et al., 1996; Formenti S.C. et al., 1997; Gaui M.F. et al., 1997; Serin D. et al., 1997).
15.4. Лечение местно-распространенного рака молочной железы, сочетающегося с беременностью
Следует признать, что данная проблема далеко не всегда имеет удовлетворительное решение, под которым подразумевается сохранение полноценного плода и выполнение всего комплекса лечебных мероприятий. Наиболее сложно планирование лечения местно-распространенного РМЖ на фоне имеющейся беременности. Основными осложняющими моментами являются: с одной стороны, эндокринная стимуляция роста опухоли; с другой — угроза самопроизвольного выкидыша, а также тератогенный эффект химиопрепаратов и лучевого воздействия, особенно актуальные на протяжении первого триместра беременности.
Выжидательная тактика (до естественного родоразрешения) по отношению к местно-распространенному РМЖ недопустима. Традиционная тактика состоит в прерывании беременности (аборт, кесарево сечение) и начале лечения РМЖ. Примером такой тактики является опыт лечения РМЖ, ассоциированного с беременностью, проводившегося в 1961-1974 гг. в РОНЦ им.Н.Н.Блохина РАМН. 26 больным РМЖ III стадии (6 – IIIa, 20 – IIIb) после прерывания беременности или оперативного родоразрешения с удалением придатков матки проводилось комплексное лечение, включавшее ХТ тиофосфамидом, РМЭ (в сочетании с удалением придатков матки если они не были удалены ранее), эндокринную терапию кортикостероидами или андрогенами. 10-летние БРВ и ОВ составили 38 и 39% соответственно (Кампова-Полевая Е.Б. и др., 2001).
Уже упоминавшийся в предыдущей главе опыт M.D. Anderson Cancer Center по применению ХТ по схеме FAC во 2-м и 3-м триместрах беременности (Berry D.L., et al., 1999), по-видимому, открывает некоторые возможности по проведению неоадъювантной или адъювантной ХТ на фоне сохраняющейся беременности, хотя отдалённые последствия такого лечения для плода неизвестны. Практически не оценёнными остаются риски развития рака, развития стерильности, мутаций половых клеток у людей, перенесших ХТ во внутриутробном периоде. Такая оценка произведена для лучевого воздействия на жертвах атомных бомбардировок в Японии. Наиболее частыми врождёнными аномалиями у лиц, облучённых во внутриутробном периоде, являются микроцефалия, умственная отсталость, задержка роста. Риск развития рака на протяжении жизни составляет 14% на 1 Гр облучения, а наследуемых болезней – 1% на 1 Гр (Greskovich J.F.Jr, et al., 2000).
При раке III стадии, выявленном в первом триместре беременности, возможности для полноценного лечения отсутствуют, необходимо настаивать на прерывании беременности.
15.5. Лечение местно-распространенного рака молочной железы, осложненного распадом опухоли
Распад или изъязвление первичной опухоли при местно-распространенном РМЖ – нередкая ситуация, являющаяся относительным показанием к паллиативной мастэктомии. Кровотечение из распадающейся опухоли является абсолютным показанием к операции. В зависимости от онкологической ситуации в целом (отсутствие или наличие отдаленных метастазов, возможность их подавления при проведении системной терапии) прогноз оперированных больных колеблется в очень широком диапазоне. Поэтому действительно паллиативное вмешательство можно выполнять только при наличии отдаленных метастазов, резистентных к системной терапии. В случаях, имеющих перспективу, необходима операция с достаточно широким иссечением кожи, чаще в варианте Холстеда, с максимальным удалением регионарной клетчатки. Обязательны адъювантная ХТ, лучевая терапия, эндокринная терапия при гормональнозависимых опухолях. Такой подход был применен к пациентке, фотографии которой приводим на рис. 5.
Рис. 5. Больная местно-распространенным РМЖ, осложненным изъязвлением опухоли. А – до операции, Б – через год после операции (без рецидива болезни).
Таким образом, при многообразии подходов к лечению местно-распространенного РМЖ можно выделить универсальные направления. Лечебная тактика предполагает проведение предоперационной ХТ, местного лечения и адъювантной терапии. Борьба за улучшение результатов лечения направлена на повышение ИД при ХТ, применение для лечения первичных больных новых препаратов или препаратов, составлявших вторую линию ХТ. Предоперационную ХТ проводят в максимально переносимых дозах, причем не менее 3 курсов. Среди схем ХТ на первом месте (если недоступны таксаны) находятся антрациклинсодержащие схемы: FAC, AC, FEC, EC. Если таксаны доступны, приходится выбирать: ТАС (АТ) или последовательное применение FAC (AC, FEC, EC) и Т. Первый вариант более логичен, т.к. самые активные препараты применяются в первую очередь, вторая последовательность показала на практике большую эффективность (Jackisch C. et al., 2002) Интенсификация дозы химиопрепаратов достигается за счёт использования Г-КСФ; местное лечение включает и облучение, и операцию. Отказ от первого или второго сопровождается высокой частотой местного рецидива. Новая тенденция в применении лучевой терапии состоит в том, что ее проводят по завершении адъювантной ХТ.
Остаются предметом исследований при лечении местно-распространенного РМЖ преимущества применения на первом этапе химиопрепаратов, традиционно относящихся ко второй линии, полезность высокодозной ХТ, разработка эффективного адъювантного лечения.
Источники литературы
Амирасланов А.Т., Касумов Н.В., Джамалов Д.Б. и др. Неоадъювантная химиотерапия при раке молочной железы // I Съезд онкологов стран СНГ. 3-6 декабря 1996, Москва. Ч. II. М., 1997. С. 480-481.
Блохин С.Н., Лактионов К.П., Портной С.М. и др. К вопросу о первичной пластике при раке молочной железы собственными тканями // Вестн. ОНЦ РАМН, 1994, Прил. С. 55-57.
Блохин С.Н. Реконструктивно-пластические операции при раке молочной железы. Автореф. дис. … докт. мед. наук. М., 2002.
Викманис У.Э. Лечение первично распространённого рака молочной железы. Автореф. дис. … канд. мед. наук. М., 1975.
Гольдман Б.Г. Внутриартериальная регионарная химиотерапия в комплексном лечении местно распространённого рака молочной железы. Автореф. дис. … канд. мед. наук.1966.
Гольдман Б.Г. Непосредственные результаты предоперационной химиотерапии рака молочной железы. Вопросы Онкологии. 1975. N 10. С. 19-21.
Даценко В.С. Комплексное лечение рака молочной железы // Вопросы Онкологии 1979. N 4. С. 54-57.
Загрекова Е.И. Неоадъювантная химиотерапия местно-распространенного рака молочной железы. Автореф. дис. … канд. мед. наук. М., 1997.
Ионеску Н., Драганеску К., Палос С., Деметриу Ф. Сочетание химиотерапии с хирургией при лечении рака молочной железы и яичников // VIII Международный Противораковый Конгресс. Т. 6. С. 286-288.
Кампова-Полевая Е.Б., Портной С.М. Рак молочной железы и беременность // V ежегодная российская онкологическая конференция конференция 27-29 ноября 2001 года, Москва. М., 2001. С. 9-11.
Лавникова Г.А. Некоторые закономерности лучевого патоморфоза опухолей человека и их практическое использование // Вестник АМН СССР. 1976. N 6. С. 13-19.
Летягин В.П., Высоцкая И.В. Первичный рак молочной железы. Диагностика, лечение, прогноз. М. 1996.
Мистакопуло М.Г., Лактионов К.П., Птушкин В.В., Портной С.М., Чимишкян К.Л., Ларионова В.Б., Жуков Н.В. Высокодозная химиотерапия в комплексном лечении инфильтративно-отечной формы рака молочной железы // VII Российский онкологический конгресс. 25-27 ноября 2003 г., Москва. М., 2003. С. 235-236.
Огнерубов Н.А., Бялик А.Я., Соловьёв А.И. и др. Выживаемость больных местнораспространённым раком молочной железы в зависимости от объёма хирургического вмешательства. // I Съезд онкологов стран СНГ. 3-6 декабря 1996, Москва. Часть II. М., 1997. С. 506.
Ориновский М.Б., Керимов Р.А., Терентьев И.Г. и др. Роль СВЧ-радиотермометрии в оценке эффекта неоадъювантной лучевой терапии у больных раком молочной железы // I Съезд онкологов стран СНГ. 3-6 декабря 1996, Москва. Ч. II. М., 1997. С. 507 — 508.
Полевая Е.Б. Лечение распространённого рака молочной железы у молодых женщин. Тезисы симпозиума, Л. 1975. С. 95-96.
Портной С.М. Рак молочной железы (факторы прогноза и лечение). Автореф. дис. … докт. мед. наук. М., 1997.
Портной С.М., Лактионов К.П., Барканов А.И., Чимишкян К.Л., Птушкин В.В., Ларионова В.Б., Жуков Н.В., Мистакопуло М.Г., Ахметов М.Ш. Опыт лечения больных прогностически отягощенным местно-распространенным раком молочной железы // IV ежегодная российская онкологическая конференция 21-23 ноября 2000 года, Москва. М., 2000. С.57-59.
Портной С.М., Лактионов К.П., Барканов А.И. Предварительные результаты органосохраняющих операций при раке молочной железы T2-3N0-2M0 после эффективной неоадъювантной химиотерапии // Herald of the International Association of Plastic Surgeons and Oncologists. 2003. N 4, Р. 35.
Репетюк Д.В., Богатырев В.Н., Портной С.М., Лактионов К.П. Количественные цитологические факторы прогноза при раке молочной железы II и III стадий в оценке эффективности неоадъювантной химиотерапии // Новости клинической цитологии России. 2003. Т.7. N 1-2. Реф. 37.
Санчакова А.В. Возможности комбинированного лечения диффузно-инфильтративных форм рака молочной железы // Вопросы Онкологии. 1972. N 4. С. 6-10.
Семиглазов В.Ф., Голубева О.М., Бавли Я.Л. и др. соавт. Адъювантная химиотерапия рака молочной железы // Вопросы онкологии. 1992. Т. 38. N10. С. 1187-1194.
Семиглазов В.Ф. Роль хирургического вмешательства в паллиативном лечении рака молочной железы // Третья ежегодная Российская онкологическая конференция 29 ноября — 1 декабря 1999 года, Санкт-Петербург. С.-П. 1999. С. 134.
Семиглазов В.Ф., Божок А.А., Иванова О.А. и др. Антрациклин-содержащая адъювантная химиотерапия в сравнении с классической схемой CMF у больных раком молочной железы с высоким риском рецидива // Вопросы онкологии. 2000. Т. 46. N2. С. 160-166.
Сидоров С.В., Малыгин Е.Н., Вардосанидзе К.В., Малыгин С.Е. Реконструкция молочной железы у больных с биологически неблагоприятными формами рака// The First international symposium plastic and reconstructive surgery in oncology. Moscow, March 19 — 21 1997. М., 1997. С. 123.
Соколова И.Г. Предоперационная полихимиотерапия в комплексном лечении местно-распространённого рака молочной железы. Дис. … канд. мед. наук. М., 1983.
Холдин С.А., Дымарский Л.Ю., Бавли Я.Л. Лечение распространённых и инфильтративных форм рака молочной железы // Новости онкологии. Л., 1971. С. 61-65.
Шомова М.В., Летягин В.П. Сравнительная оценка эффективности двух схем комплексного лечения больных местнораспространённым раком молочной железы // I Съезд онкологов стран СНГ. 3-6 декабря 1996, Москва. Ч. II. М., 1997. С. 522.
Шомова М.В. Факторы прогноза, особенности течения и современные подходы к лечению больных местнораспространённым раком молочной железы. Автореф. дис. … докт. мед. наук. М., 1999.
Alvarez A., Mickiewicz E., Brosio C. et al. Is the number of involved resected nodes (N) a predictive prognostic factor for disease free survival (DFS) and survival (OS) for stage III breast cancer (BC)? //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 548.
Amorosa D., Boccardo F., Rubagotti A., et al. Adjuvant high-dose chemotherapy (HD-CT) without bone marrow rescue in breast cancer patients (b.c.pts) with 10 or more positive nodes (N>=10): preliminary results of an Italian Breast Cancer Adjuvant Study Group (GROCTA) trial //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 505.
Anelli A., de Albuquerque A.A., Tabacof J., et al. Paclitaxel (PTX) and doxorubicin (Dox) as neoadjuvant chemotherapy (NCT) in locally advanced breast cancer — preliminary results //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 550.
Artal A., Alonso V., Gallego O. et al. FEC-75 plus G-CSF in locally advanced breast carcinoma // Eur. J. Cancer. 1996. Vol. 32A, Suppl. 2. P. 5-14.
Baillet F., Rozec C., Ucla L. et al. Treatment of locally advanced breast cancer without mastectomy: 5- and 10-yr results of 135 tumors larger than 5 cm treated by external-beam therapy, brachytherapy and neoadjuvant chemotherapy // Pisa Symposia in Oncology. Breast Cancer: From Biology to Therapy. October 19-21, 1992. Pisa, P. 22.
Baltali E., Altundag M.K., Onat D.A. et al. Neoadjuvant chemotherapy with taxotere-epirubicin-5-fluorouracili (TEF) in local-regionally advanced breast cancer: a preliminary report // Tumori. 2002. Vol. 88. N 6. P. 474-477.
Barni S., Piazza E., Frontini L. et al. Three year survival and relapse after neoadjuvant high dose epidoxorubicin (EPI) in stage II-IIIa breast cancer //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 556.
Bear H.D., Anderson S., Brown A. et al. The effect on tumor response of adding sequential preoperative docetaxel to preoperative doxorubicin and cyclophosphamide: preliminary results from National Surgical Adjuvant Breast and Bowel Project Protocol B-27 // J. Clin. Oncol. 2003. Vol. 21. N 22. P. 4165-4174.
Bergh J., Wiklund T., Erikstein B. et al. Tailored fluorourcil, epirubicin, and cyclophosphamide compared with marrow-supported high-dose chemotherapy as adjuvant treatment for high-risk breastcancer: a randomized trial. Scandinavian breast group 9401 study // Lancet. 2000. Vol. 356. P. 1384-1391.
Berry D.L., Theriault R.L., Holmes F.A. et al. Management of breast cancer during pregnancy using a standardized protocol // J. Clin. Oncol. 1999. Vol. 17. N 3. P. 855-861.
Bitran J.D., Samuels B.L., Klein L.M., et al. Autologous bone marrow transplantation (ABMT) for women with stage II and IIIa high risk (>10 involved lymph nodes) breast cancer //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 15. P. 184.
Blokhin S.N., Portnoj S.M., Lactionov K.P. et al. Immediate breast reconstruction (IBR) in breast cancer patients // Eur. J. Cancer. 1996. Vol. 32A, Suppl. 2. P. 2-14.
Bou-Khalil J., Rose M., Psyrri A., D’Andrea E., Medoff E., Staugaard-Hahn C., Holtkamp C., Gran S., Pezzimente J., Snyder E., Cooper D., Haffty B., Reiss M., Burtness B. Sequential high-dose alkylating therapy and stem cell support for high-risk stage III breast cancer // Breast J. 2003. Vol. 9. N 6. P. 472-477.
Breier S., Lebedinsky C., Giangiacomo G., et al. Intensive chemotherapy with 15 days interval with G-CSF support in locally advanced breast cancer (LABC) patients (pts) //Proc. Am. Soc. Clin. Oncol. 1996. Vol. 15. P.188.
Buric M., Filipovic S., Projevic M., Veselinovic S. Metastatic dissemination in the inflammatory breast cancer (IBC) // Eur. J. Cancer. 1996. Vol. 32A, Suppl. 2. P. 8-22.
Calais G., Descamps P., Chapet S. et al. Primary chemotherapy and radiosurgical breast-conserving treatment for patients with locally advanced operable breast cancers // Int. J. Radiat. Oncol. Biol. Phys. 1993. Vol. 26, N 1. P. 37-42.
Chin P.L., Andersen J.S., Somlo G., Chu D.Z., Schwarz R.E., Ellenhorn J.D. Esthetic reconstruction after mastectomy for inflammatory breast cancer: is it worthwhile? // J. Am. Coll. Surg. 2000. Vol. 190, N 3. P. 304-309.
Colozza M., Gori S., Mosconi A.M. et al. Induction chemotherapy with cisplatin, doxorubicin, and cyclophosphamide (CAP) in a combined modality approach for locally advanced and inflammatory breast cancer. Long-term results // Am. J. Clin. Oncol. 1996. Vol. 19, N 1. P. 10-17.
Coskun U., Gunel N., Onuk E. et al. Effect of different neoadjuvant chemotherapy regimens on locally advanced breast cancer // Neoplasma. 2003. Vol. 50, N 3. P. 210-216.
Dazzi C., Cariello A., Rosti G., Tienghi A., Molino A., Sabbatini R., Aieta M., Frassineti G.L., Vertogen B., Giovanis P., Marangolo M. Neoadjuvant high dose chemotherapy plus peripheral blood progenitor cells in inflammatory breast cancer: a multicenter phase II pilot study // Haematologica. 2001.Vol. 86, N 5. P. 523-529.
Demetri G.D., Berry D., Norton L., et al. Clinical outcomes of node-positive breast cancer patients treated with dose-intensified Adriamycin/cyclophosphamide (AC) followed by Taxol (T) as adjuvant systemic chemotherapy (CALGB 9141) //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 503.
Dieras V., M.Jouve, B.Asselain, et al. S-phase fraction (SPF) and response to primary chemotherapy (CT) for breast cancer (BC): predictive factor for responce but poor prognostic factor for survival //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 495.
Dohollou N., Floquet A., Pigneux A. et al. Neoadjuvant chemotherapy by VEC regimen in breast cancer. Preliminary results of a phase II trial // Eur. J. Cancer. 1996. Vol. 32A, Suppl. 2. P. 7-2.
Early Breast Cancer Trialists’ Collaborative Group. Polychemotherapy for early breast cancer: an overview of the randomized trials // Lancet. 1998. Vol. 352, N 9132. 930-942.
Ewers S.B., Attewell R., Baldetorp B. et al. Flow cytometry DNA analysis and prediction of loco-regional recurrences after mastectomy in breast cancer // Acta Oncol. 1992. Vol. 31, N 7. P. 733-740.
Ezzat A., Rahai M., Bazarbashi S., et al. High complete pathological response (CpR) induced by circadian Taxol (T) and cis-platinum (P) in locally advanced breast cancer (ABC) //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 586.
Fein D.A., Mendenhall N.P., Marsh R.D. et al. Results of multimodality therapy for inflammatory breast cancer: an analysis of clinical and treatment factors affecting outcome // Am. Surg. 1994. Vol. 60, N 3. P. 220-225.
Ferriere J.P., Assier I., van Praagh I., et al. Primary chemotherapy in breast cancer (BC): correlation between tumor response and patient outcome//Proc. Am. Soc. Clin. Oncol. 1996. Vol. 15. P. 84.
Formenti S.C., Dunnington G., Lenz H., et al. Original p53 status predicts for pathological response to 5-fluorouracil and radiation in locally advanced breast cancer //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 590.
Formenti S.C., Lenz J., Dunnington G., et al. Initial р53 status as potential predictor for pathological response to the combination of 5FU and radiotherapy in locally advanced breast cancer //Proc. Am. Soc. Clin. Oncol. 1996. Vol. 15. P. 174.
Fornasiero A., Ghiotto C., Daniele O., Favaretto A.G., D’Amanzo P., Ziade A. Neoadjuvant moderately high-dose chemotherapy with rh-G-CSF in locally advanced breast carcinoma // Tumori. 2001. Vol. 87, N 4. P. 223-228.
Forouhi P., Walsh J.S., Anderson T.J., Chetty U. Ultrasonography as a method of measuring breast tumor size and monitiring response to primary systemic treatment // Br. J. Surg. 1994. Vol. 81, N 2. P. 223-225.
Fountzilas G., Papadimitriou C., Aravantinos G., Nicolaides C., Stathopoulos G., Bafaloukos D., Kalofonos H., Ekonomopoulos T., Skarlos D., Pavlidis N., Dimopoulos A.M. Dose-dense sequential adjuvant chemotherapy with epirubicin, paclitaxel and CMF in high-risk breast cancer // Oncology. 2001. Vol. 60, N 3. P. 214-220.
Fourquet A., Campana F., Scholl S. et al. Primary chemotherapy or primary radiotherapy: a possibility to preserve the breast in large tumors // International Congress of Radiation Oncology 1993. June 21-25. Kyoto, 1993. P. 112.
Frassoldati A., Adami F., Banzi M.C. et al., Breast cancer cell phenotype is modified by primary chemotherapy //Proc. Am. Soc. Clin. Oncol. 1996. Vol. 15. P. 109.
Fumoleau P., Chauvin F., Namer M. et al. Three-year follow-up results of adjuvant chemotherapy with AC versus high-dose mitoxantrone, cyclophosphamide (MC) with filgastim in operable breast cancer involving 10 or more axillary lymph nodes //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 504.
Fumoleau P., Chauvin F., Namer M., Bugat R., Tubiana-Hulin M., Guastalla J.P., Delozier T., Kerbrat P., Devaux Y., Bonneterre J., Filleul A., Clavel M. Intensification of adjuvant chemotherapy: 5-year results of a randomized trial comparing conventional doxorubicin and cyclophosphamide with high-dose mitoxantrone and cyclophosphamide with filgrastim in operable breast cancer with 10 or more involved axillary nodes // J. Clin. Oncol. 2001. Vol. 19, N 3. P. 612-620.
Gallioni E., Cetto G., Nascimben O. et al. Adjuvant chemotherapy with high-dose epirubicin and cyclophosphamide (EC), methotrexate, fluorouracil (CMF) in high risk premenopausal breast cancer patients (pts). A prospective randomized trial //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 508.
Gaui M.F., Salgado R., Rotstein C. et al. Cisplatin (C), 5-fluorouracil (FU) and radiotherapy (XRT) neoadjuvant (Naj) for locally advanced breast cancer (LABC), resistant to antracyclines //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 596.
Gianni L., Demicheli R., Moliterni A., et al., Pilot study of primary chemotherapy with doxorubicin-paclitaxel (AT) in women with T2-T3 or locally advanced breast carcinoma //Proc. Am. Soc. Clin. Oncol. 1996. Vol. 15. P. 129.
Gradishar W.J., Loh K., Erban J. et al. Preliminary results from a phase II study of (Taxotere [T]) docetaxel as primary chemotherapy (PCT) followed by doxorubicin (A) and cyclophosphamide (C) in stage III breast cancer //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 599.
Graham M., Gonzalez P., Cance W. et al. Dose-intensive sequential adriamycin (A) and iv CMF (A>CMF) with G-CSF (G) support for stage II and III breast cancer (BrCa): a feasible and effective outpatient regimen //Proc. Am. Soc. Clin. Oncol. 1996. Vol. 15. P. 137.
Greskovich J.F. Jr., Macklis R.M. Radiation therapy in pregnancy: risk calculation and risk minimization // Semin. Oncol.. 2000. Vol. 27, N 6. P. 633-645.
Haagensen C., Stout A. Carcinoma of the breast: criteria of operability // Ann. Surg. 1943. Vol. 118, P.1032-1052.
Haagensen C. Diseases of the breast. 1965.
Hutcheon A.W., Heys S.D., Sarkar T.K. et al. Docetaxel primary chemotherapy in breast cancer: a five year update of the Aberdeen trial // Breast Cancer Res. Treat. 2003. Vol. 82, Suppl. 1. S9. Abstr. 11.
Jackisch C., von Minckwitz G., Raab G. et al. Primary endpoint analysis of the Geparduo-study: preoperative chemotherapy (PCT) comparing dose-dense versus sequential adriamycin/docetaxel combination in operable breast cancer (T2-3, N0-2, M0) // Breast Cancer Res. Treat. 2002. Vol. 76. S90. Abstr. 152.
Jaiyesimi I.A., Dmuchowski C., Morris L. et al. Pattern of survival in operabel breast cancer patients with 10 or more nodal metastases: an 18-year, single-institution study //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 613.
Janvier M., Spielman M., Nogues C. et al. A randomised trial of maintenance therapy for non-metastatic inflammatory breast cancer (IBC) //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 524.
Klumpp T.R., Goldberg S.L., Magdalinski A.J., Mangan K.F. Adjuvant high-dose cyclophosphamide, etoposide, and carboplatin (CEC) followed by autologous hematopoetic stem cell transplantation for high-risk non-metastatic breast cancer //Proc. Am. Soc. Clin. Oncol. 1996. Vol. 15. P. 210.
Lara F.U., Castaneda N., Ramirez M.T. et al. Neoadjuvant (NA) taxol (T) in stage III breast cancer (BC) //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 626.
Letyagin V., Shomova M., Visotskaya I. et al. Chemoradiotherapy in complex treatment of locally advanced breast cancer // Eur. J. Cancer. 1996. Vol. 32A, Suppl. 2. P. 8-13.
Machiavelli M., Romero A., Perez J. et al. Prognostic significance of pathologic response (PTR) after preoperative chemotherapy (PCT) for locally advanced breast carcinoma (LABC) //Proc. Am. Soc. Clin. Oncol. 1996. Vol. 15. P. 73.
Mangalik A., Dressler L., Lafrado L. Effect of neoadjuvant chemotherapy in breast cancer with expression of the molecular markers p53 and her-2/neu and correlation with clinical outcome //Proc. Am. Soc. Clin. Oncol. 1996. Vol. 15. P. 1818.
Mankoff D.A., Gralow J.R., Dunwald L.K. et al. Monitoring response to neoadjuvant chemotherapy in locally advanced breast cancer patients using [Tc-99m]-Sestamibi scintimammography //Proc. Am. Soc. Clin. Oncol. 1996. Vol. 15. P. 214.
Massidda B., Ionta M.T., Foddi M.R. et al. Five-year results of a multimodal management of stage IIIb breast cancer // Eur. J. Cancer. 1996. Vol. 32A, Suppl. 2. P. 8-14.
de Matteis A., Nuzzo F., D`Aiuto G. et al. Docetaxel plus epidoxorubicin as neoadjuvant treatment in patients with large operable or locally advanced carcinoma of the breast: a single-center, phase II study // Cancer. 2002. Vol. 94, N 4. P. 895-901.
McLaren D.B., Keen C.W., Webster D.W., Barrett-Lee P.J. 15 years of neoadjuvant chemotherapy in advanced carcinoma of the breast // Br. J. Cancer. 1995. Vol. 72, Suppl. 25 P. 4.
von Minckwitz G., Costa S.D., Raab G., Blohmer J.U., Eidtmann H., Hilfrich J., Merkle E., Jackisch C., Gademann G., Tulusan A.H., Eiermann W., Graf E., Kaufmann M. German Preoperative Adriamycin-Docetaxel and German Adjuvant Breast Cancer Study Groups. Dose-dense doxorubicin, docetaxel, and granulocyte colony-stimulating factor support with or without tamoxifen as preoperative therapy in patients with operable carcinoma of the breast: a randomized, controlled, open phase IIb study // J. Clin. Oncol. 2001. Vol. 19, N 15. P. 3506-3515.
Morrell L.E., Lee Y.J., Hurley J. et al. Phase II trial of neoadjuvant methotrexate, vinblastine, doxorubicin and cisplatin (MVAC) in the treatment of locally advanced breast cancer (LABC) //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 643.
Osborne M.P., Borgen P.I. Role of mastectomy in breast cancer // Surg. Clin. North Am. 1990. Vol. 70, N 5. P.1023-1046.
Paciucci P.A., Raptis G., Bleiweiss I. et al. Neo-adjuvant therapy with dose-dense docetaxel plus short-term filgrastim rescue for locally advanced breast cancer // Anticancer Drugs. 2002. Vol. 13, N 8. P. 791-795.
Palangie T., Beuzeboc P., Dieras V. et al. Salvage high-dose chemotherapy (CT) for non-responding breast cancers (BC) with >4 involved axillary lymph nodes (LN) after primary CT: a feassibility study //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 650.
Perez-Gracia J.L., Colomer R., Esteban E., Barcelo R., Benavides M., Puertas J., Arcediano A., Tornamira M.V., Valentin V., Munoz A., Cortes-Funes H., Hornedo J. High-dose mitoxantrone and cyclophosphamide without stem cell support in patients with high-risk and advanced breast carcinoma: a Phase II multicentric trial // Cancer. 2001. Vol. 92, N 10. P. 2508-2516.
Peters W., Rosner G., Vredenburgh J., Shpall E. et all. A prospective, randomized comparison of two doses of combination alkylating agents (AA) as consolidation after CAF in high-risk primary breast cancer involving ten or more axillary lymph nodes (LN): Preliminary results of CALGB 9082/SWOG 9114 / NCIC MA-13 //Proc. Am. Soc. Clin. Oncol. 1999. Vol. 18. P. 2.
Pinedo H.M., Honkoop A.H., Boven E. et al. Improved disease-free survival (DFS) of patients with locally advanced breast cancer (LABC) using prolonged dose intensive neoadjuvant doxorubicin (A), cyclophosphamide (C) and GM-CSF //Proc. Am. Soc. Clin. Oncol. 1996. Vol. 15. P. 88.
Porter K.A., Burstein N. Flow cytometry analysis in locally advanced breast cancer //Proc. Am. Soc. Clin. Oncol. 1996. Vol. 15. P. 230.
Portnoj S., Blokhin S., Lactionov K., Barkanov A. Immediate breast reconstruction in stage III breast cancer patients // 4-th European Breast Cancer Conference, Hamburg, 16-20 March 2004. Abstract book. Eur. J. Cancer. 2004. V.2, N3, Suppl. Abstr. 287.
Rainer H. Prospective randomized clinical trial of primary treatment in breast cancer stages T3/4, N+/-,M0. Chemotherapy vs. radiotherapy. Arbeitskreis fur perioperative chemotherapie // Anticancer Res. 1993. Vol. 13, N5. P. 1917-1923.
Reemstma K., Ryan R.F., Krements E.T., Creech O. Treatment of selected adenocarcinomas by perfusion technique // Arch. Surg. 1959. Vol. 78, N 5. P. 724-728.
Roche H., Chevallier B., Chollet P. et al. Three-year follow-up results of an intensive induction chemotherapy (FEC-HD) followed by adjuvant chemotherapy (FEC 75) in non-metastatic unilateral inflammatory breast cancer patients //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 506.
Roche H., Chevreau C., Mihura J. et al. Intensive chemotherapy program with autologous bone marrow transplantation (ABMT) in non metastatic inflammatory breast cancer: mature results // Eur. J. Cancer. 1996. Vol. 32A, Suppl. 2. P. 5-12.
Roche H., Viens P., Biron P. et al. High-dose chemotherapy for breast cancer: the French PEGASE experience // Cancer control. 2003. Vol. 10, N 1. P. 42-47.
Rodenhuis S., Bontenbal M., Beex L.V. et al. High-dose chemotherapy with hematopoietic stem-cell rescue for high-risk breast cancer. Netherlands Working Party on Autologous Transplantation in Solid Tumors // N. Engl. J. Med. 2003. Vol. 349, N 1. P. 7-16.
Rutgers E.J.Th., Richel D.J., Baars J.W. et al. Preliminary analysis of a randomized phase II study of high-dose chemotherapy in high-risk breast cancer // Eur. J. Cancer. 1996. Vol. 32A, Suppl. 2. P. 5-1.
Scholl S.M., Pierga J.Y., Asselain B. et al. Breast tumour response to primary chemotherapy predicts local and distant control as well as survival // Eur. J. Cancer. 1995. Vol. 31A, N 12. P. 1969-1975.
Schwartz G.F., Lange A.K., Topham A.K. Breast conservation following induction chemotherapy for locally advanced carcinoma of the breast (stages IIB and III). A surgical perspective // Surg. Oncol. Clin. N. Am. 1995. Vol. 4, N 4. P. 657-669.
Schwartzberg L., Birch R., Weaver C. et al. Neoadjuvant chemotherapy with or without paclitaxel and high-dose chemotherapy (HDC) with peripheral blood progenitor cell (PBPC) support for locally advanced breast cancer (LABC) //Proc. Am. Soc. Clin. Oncol. 1996. Vol. 15. P. 160.
Semiglazov V.F., Topuzov E.E., Bavli J.L., Moiseyenko V.M., Ivanova O.A., Seleznev I.K., Orlov A.A., Barash N.Y., Golubeva O.M., Chepic O.F. Primary (neoadjuvant) chemotherapy and radiotherapy compared with primary radiotherapy alone in stage IIb-IIIa breast cancer // Ann. Oncol. 1994. Vol. 5, N 7. P. 591-595.
Semiglazov V.F., Golubeva O.M. Adriablastin vs. CMF in adjuvant treatment of breast cancer (T3N0-2M0) // Adjuvant therapy of primary breast cancer. 5-th International conference. March 1- 4, 1995. St.Gallen, 1995. P. 65.
Serin D., Brewer Y., Kirscher S. et al. Concurrent neoadjuvant chemoradiation therapy in stages IIa, IIb, IIIa and IIIb breast cancer: preliminary results on pathological response //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 667.
Shparik J. Breast cancer in 1980: meta-analysis of dose intensity (neoadjuvant chemotherapy) // Eur. J. Cancer. 1996. Vol. 32A, Suppl. 2. P. 8-10.
Singh G., Singh D.P., Gupta D., Muralikrishna B.V. Neoadjuvant chemotherapy in locally advanced breast cancer // J. Surg. Oncol. 1996. Vol. 61, N1 P. 38-41.
Smith I.C., Heys S.D., Hutcheon A.W. et al. Neoadjuvant chemotherapy in breast cancer: significantly enhanced response with docetaxel // J. Clin. Oncol. 2002. Vol. 20, N 6. P. 1456-1466.
Smith R.E. Risk for the development of treatment-related acute myelocytic leukemia and myelodysplastic syndrome among patients with breast cancer: review of the literature and the National Surgical Adjuvant Breast and Bowel Project experience // Clin Breast Cancer. 2003. Vol. 4. N 4. P. 273-279.
Somlo G., Simpson J., Doroshow J. et al. Immunohistochemical (IH) expression of p53, estrogen (ER) and progesterone (PR) receptors and MIB-1 as well as increased mitotic index (MI) are predictors of outcome after high-dose chemotherapy (HDCT) and stem cell rescue (SCR) for high-risk breast cancer (HRBC) patients (pts) //Proc. Am. Soc. Clin. Oncol. 1996. Vol. 15. P. 170.
Tallman M.S., Gray R., Robert N.J. et al. Conventional adjuvant chemotherapy with or without high-dose chemotherapy and autologous stem-cell transplantation in high-risk breast cancer // N. Engl. J. Med. 2003. Vol. 349, N 1. P. 17-26.
Taucher S., Gnant M., Kandioler D. et al. Interactions of risk factors, primary response, and survival after neoadjuvant cytotoxic chemotherapy in patients with stage I — III breast cancer //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 680.
Therasse P., Mauriac L., Welnicka-Jaskiewicz M., Bruning P., Cufer T., Bonnefoi H., Tomiak E., Pritchard K.I., Hamilton A., Piccart M.J. EORTC. Final results of a randomized phase III trial comparing cyclophosphamide, epirubicin, and fluorouracil with a dose-intensified epirubicin and cyclophosphamide + filgrastim as neoadjuvant treatment in locally advanced breast cancer: an EORTC-NCIC-SAKK multicenter study // J. Clin. Oncol. 2003. Vol. 21, N 5. P. 843-850.
The Scandinavian Breast Cancer Study Group 9401. Results from a randomized adjuvant breast cancer study with high dose chemotherapy with CTCb supported by autologous bone marrow stem cells versus dose escalated and tailored FEC therapy //Proc. Am. Soc. Clin. Oncol. 1999. Vol. 18. P. 3.
Touboul E., Lefranc J.P., Blondon J. et al. Multidisciplinary treatment approach to locally advanced non-inflammatory breast cancer using chemotherapy and radiotherapy with or without surgery // Radiother. Oncol. 1992. Vol. 25, N 3. P. 167-175.
Tulusan A.H., Dietzel-Drenwert S., Feltman K. et al. Neoadjuvant chemotherapy with high-dose epirubicin-cyclophosphamide for locally advanced breast cancer and the importance of p53 as potential predictor for response //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 682.
Veronesi U., Bonadonna G., Zurrida S. et al. Conservation surgery after primary chemotherapy in large carcinomas of the breast // Ann. Surg. 1995. Vol. 222, N 5. P. 612-618.
Wallwiener D., Haas R., Solomayer E.F. et al. Problem analysis and perioperative management after neoadjuvant chemotherapy (NACT) for locally advanced breast cancer (LABC) — matched pairs analysis (n=152) and first results of neoadjuvant high-dose chemotherapy (HD-NACT) //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 694.
Wong A., Mullai N., Parveez R., Shiomoto G. Neoadjuvant CMF versus CAF for locoregionally advanced breast cancer //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P 696.
Yau J., Lee K., Verma S. et al. A phase III study of high dose cyclophosphamide, etoposide, and cisplatin (HDCVP) without marrow or stem cells support in patients with high risk primary breast carcinoma //Proc. Am. Soc. Clin. Oncol. 1996. Vol. 15. P. 19).
Zambetti M., Oriana S., Terenziani M. et al. Combined modality treatment in locally advanced breast cancer (LABC) with anthracycline primary chemotherapy (PC) //Proc. Am. Soc. Clin. Oncol. 1997. Vol. 16. P. 699.
Zucali R., Uslenghi C., Kenda R., Bonadonna G. Natural history and survival of inoperable breast cancer treated with radiotherapy and radiotherapy followed by radical mastectomy // Cancer. 1976. Vol. 37, N 3. P. 1422-1431.
Zujewski J., Danforth D., Noone M. et al. Short course, dose intensive, 14 day cycles of doxorubicin (A) and cyclophosphamide © followed by infusional paclitaxel (T) in the treatment of high risk primary breast cancer //Proc. Am. Soc. Clin. Oncol. 1996. Vol. 15. P. 145.