Возраст
Дискуссия о зависимости течения РМЖ от возраста больной в 90-е годы ХХ века обогатилась результатами новых исследований, включавших многофакторный анализ, что позволило отказаться от гипотезы о доминирующем влиянии большей исходной распространённости опухоли, нередко наблюдаемой у 20 — 39-летних больных. Цель дискуссии состояла в ответе на вопрос: имеет ли место утяжеление течения болезни в крайних возрастных группах — до 35 — 40 лет, с одной стороны, и старше 65-70 лет, с другой?
J.M.Kurtz и соавт. (1988) проанализировали закономерности развития местного рецидива РМЖ в молочной железе после органосохраняющих операций, дополненных лучевой терапией (ЛТ), у 1382 больных. В возрастной группе до 40 лет местный рецидив развился за 5-лет в 19% случаев, а в группе больных старше 40 лет — в 9% случаев. P.T.Neff и соавт. (1996) у больных после органосохраняющих операций с ЛТ при медиане прослеженности 5 лет местный рецидив в молочной железе наблюдался в возрасте до 40 лет в 24% случаев, старше 40 лет — в 6 % случаев (р<0.05) .
B.L.Fowble и соавт. (1994) сравнили течение РМЖ в следующих возрастных группах: до 35 лет включительно (n=64); 36-50 лет (n=363); старше 50 лет (n=363). При непораженных лимфатических узлах общая выживаемость (ОВ) в 1-3-й группах составила 71, 83 и 92%, безрецидивная выживаемость (БРВ) — 51, 65 и 76% соответственно. Частота местного рецидива в молочной железе при выполнении органосохраняющей операции и облучения — 40, 16 и 13% соответственно (различия статистически значимы, средняя длительность наблюдений 4.6 года). При поражении лимфатических узлов отдалённые результаты лечения не зависели от возраста больных.
L.Molnar и соавт. (1995) наблюдали не объяснимое только степенью распространённости РМЖ снижение выживаемости больных в возрасте моложе 35 лет по сравнению с другими возрастными группами.
A.de la Rochefordiere и соавт. (1993) проанализировали течение РМЖ I-III стадий у 1703 больных репродуктивного возраста. Наихудшие показатели БРВ и ОВ отмечены у больных до 33 лет; это не было связано с размером первичной опухоли, поражением лимфатических узлов, степенью злокачественности, содержанием гормональных рецепторов, вариантом местного лечения и системной терапией.
A.E.Lethaby и соавт. (1992) у 2706 больных РМЖ изучали зависимость ОВ от возраста. Сравнение проводили в четырёх возрастных группах: до 35 лет, 35- 49 лет, 50 — 74 года и 75 лет и старше. В первой возрастной группе отмечено статистически значимое сокращение ОВ. Достоверных изменений ОВ в других возрастных группах не наблюдалось.
М.Namer и соавт. (1993), не выделяя “молодой” возрастной группы, сравнили отдалённые результаты лечения больных до 50 лет (n=509), 50 — 59 лет (n=505), 60 — 69 лет (n=530), 70 лет и старше (n=479). Анализ ОВ показал, что чем моложе больные, тем выше показатели их выживаемости. Так, самыми низкими они были у пациенток 70 лет и старше, однако при анализе случаев смерти только от рака статистически значимые различия выживаемости между возрастными группами исчезали.
По данным G.H.Lyman и соавт. (1994), у больных, начиная с 65-летнего возраста, течение болезни не отличается от такового у молодых пациенток. В работе Т.М.Law и соавт. (1996) отдалённые результаты лечения больных старше 70 лет сравнимы с таковыми в младших возрастных группах.
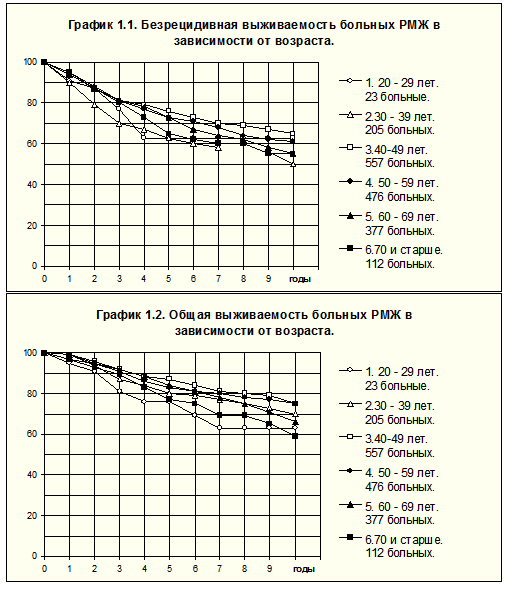
В РОНЦ им. Н.Н.Блохина РАМН проанализирована зависимость течения РМЖ I-III стадии от возраста путём сравнения БРВ и ОВ больных шести возрастных групп (рис. 1). Отмечено относительное ухудшение течения болезни в крайних возрастных группах, показатели БРВ больных 1-й и 2-й групп одни из самых низких, БРВ больных 2-й группы статистически значимо хуже, чем больных 3-й (р=0.00062) и 4 групп (р=0.00521); ОВ пациенток 1-й группы имеет тенденцию к более низким величинам, чем в 3-й группе (р=0.0718), а в 6-й группе статистически значимо ниже, чем в 3-й (р= 0.00696) и 4-й (р=0.0463).
У больных 20-39 лет значительно чаще, чем в среднем и пожилом возрасте, наблюдалось поражение регионарных лимфатических узлов и реже — опухоли, оцениваемые критерием Т1 (табл. 1, 2). С другой стороны, у больных 5-й и 6-й групп чаще имели место отсутствие адъювантной системной терапии при поражении регионарных лимфатических узлов (24% против 11% у больных 1-4-й группах), смерть от причин, не связанных с развитием метастазов (2 % против 0.4% у больных 1-4-й группах), а также меньшая интенсивность дозы препаратов при проведении адъювантной ХТ.
Таблица 1. Частота (в %) поражения регионарных лимфатических узлов в зависимости от возраста пациенток
| Возрастная группа, годы | N0 | N1 | N2 | Итого |
| 20 – 29 | 26% (6) | 61% (14) | 13% (3) | 100% (23) |
| 30 – 39 | 46% (95) | 41% (83) | 13% (27) | 100% (205) |
| 40 – 49 | 56% (312) | 35% (194) | 9% (51) | 100% (557) |
| 50 – 59 | 53% (252) | 38% (179) | 9% (45) | 100% (476) |
| 60 – 69 | 64% (242) | 30% (114) | 6% (21) | 100 % (377) |
| 70 и старше | 68% (76) | 28% (32) | 4% (4) | 100% (112) |
| Всего | 56% (983) | 35% (616) | 9% (151) | 100% (1750) |
Таблица 2. Частота (в %) различных значений критерия Т в зависимости от возраста пациенток.
| Возрастная группа, годы | T1a,b,c | T2 | T3 | T4a,b,c | Итого |
| 20 — 29 | 39% (9) | 39% (9) | 13% (3) | 9% (2) | 100% (23) |
| 30 — 39 | 45% (93) | 36% (73) | 6% (13) | 13% (26) | 100% (205) |
| 40 — 49 | 44 % (244) | 41% (228) | 4% (21) | 11% (64) | 100% (557) |
| 50 — 59 | 47% (223) | 38% (181) | 5% (22) | 10% (50) | 100% (476) |
| 60 — 69 | 55% (208) | 34% (129) | 2% (7) | 9% (33) | 100% (377) |
| 70 и старше | 50% (56) | 42% (47) | 1% (1) | 7% (8) | 100% (112) |
| Всего | 48% (833) | 38% (667) | 4% (67) | 10% (183) | 100% (1750) |
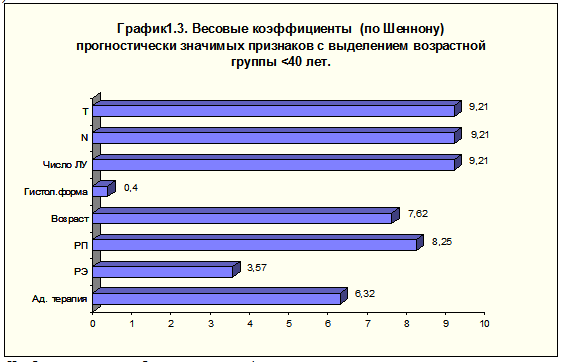
Многофакторный анализ включал следующие критерии: гистологическая форма рака (градации: протоковый + дольковый + без уточнения формы; медуллярный + слизистый + папиллярный + тубулярный), уровень РЭ (градации: РЭ-, РЭ+), уровень РП (градации: РП-, РП+), адъювантная терапия (градации: не проводилась, проводилась), число поражённых лимфатических узлов (градации: 0,1-3,4 и больше), показатель “N” (градации: N0, N1, N2), показатель “T” (градации Т1, Т2, Т3, Т4) и возраст (градации: до 39 лет включительно, 40 и старше).
Наиболее значимыми были клинико-морфологические характеристики местно-регионарного распространения опухоли (показатели T, N и число поражённых лимфатических узлов), далее по мере убывания прогностической значимости признака следовали уровень РП, возраст, адъювантная терапия, уровень РЭ и гистологическая форма рака (рис. 2). Таким образом, возраст до 40 лет можно считать независимым признаком более быстрого развития болезни.
Репродуктивный статус
Значение репродуктивного статуса больной как фактора, существенно изменяющего эффективность адъювантной химиотерапии, известно с 80-х годов ХХ века. По данным В.Ф.Семиглазова и соавт. (1983), профилактическая химиотерапия больных РМЖ, находящихся в менопаузе, — неэффективна. G.Bonadonna и соавт. (1985) показали, что адъювантная ХТ по схеме CMF эффективна у пациенток в репродуктивном периоде, но не в менопаузе.
К сожалению, наш опыт полностью подтверждает такую точку зрения. У больных в менопаузе эффективность адъювантной ХТ по схеме CMF была близка к нулю даже среди пациенток с интенсивностью дозы каждого из препаратов более 50% от должной. Собственного прогностического значения, по нашим данным, репродуктивный статус не имеет (С.М.Портной, 1997).
B.Fisher и соавт. (1990) продемонстрировали эффективность адъювантной ХТ по схеме АС у больных, находящихся в менопаузе.
В работе С.Focan и соавт. (1995) описаны сложные эффекты ХТ и эндокринной терапии, зависящие, в том числе и от репродуктивного статуса больных. Больные РМЖ с поражением лимфатических узлов после оперативного лечения (n=281) были рандомизированы на проведение ХТ по схеме CMF и сочетание ХТ по схеме CMF с эндокринной терапией высокими дозами медроксипрогестерона ацетата. Больные РМЖ без поражения лимфатических узлов (n=260) рандомизированы на: проведение эндокринной терапии высокими дозами медроксипрогестерона ацетата и на отсутствие эндокринной терапии. У больных без адъювантной терапии в зависимости от репродуктивного статуса показатели БРВ и ОВ не различались; в репродуктивном возрасте эндокринная терапия была эффективнее, чем в менопаузе. При поражении лимфатических узлов у больных в менопаузе сочетание эндокринной терапии с ХТ достоверно более действенно, чем только ХТ; в репродуктивном возрасте, напротив, ХТ в сочетании с эндокринной терапией оказалась менее эффективной, чем просто ХТ (различия в отношении БРВ и ОВ статистически значимы).
Объединенной группой исследователей раннего рака молочной железы (Early Breast Cancer Trialists’ Collaborative Group, 1998) проведен мета-анализ 47 рандомизированных исследований, посвящённых оценке эффективности адъювантной ХТ по схемам CMF, антрациклин-содержащим схемам и другим схемам. На огромном материале (18718 больных) показано достоверное снижение частоты рецидива болезни на 34–37% у больных до 50 лет и на 18– 22% у больных старше 50 лет, за исключением возрастной группы 70 лет и старше. В последней группе ХТ статистически значимо не влияла ни на частоту возврата болезни, ни на смертность. Снижение смертности составило 27% у больных до 50 лет и 8–14 % у больных 50–69 лет.
Фаза овариально-менструального цикла
В 90-е годы появилось множество публикаций о влиянии фазы овариально-менструального цикла, приходящейся на день операции. В ряде ретроспективных исследований показано, что у больных РМЖ с поражением лимфатических узлов, оперированных в лютеиновую фазу цикла, БРВ была статистически значимо выше, чем у оперированных в фолликулиновую фазу цикла (Badwe R.A. et al., 1991; Senie RT. et al.,1991; Veronesi U. et al.,1994). В других работах такая закономерность не подтверждалась (McGuire W.L. et al.,1992; Gnant M.F. et al.,1992; Nathan B. et al.,1993).
Нарастает объём анализируемого материала, число больных включённых в анализ измеряется тысячами, но выводы остаются противоречивыми: Jager W. И Sauerbrei W. (1995); N.T.Kroman и соавт. (1995), не обнаружили заметных различий в течении болезни. По мнению М.Levine и соавт. (1996), имеет место обратная закономерность, т.е. у оперированных в лютеиновую фазу цикла больных вероятность рецидива болезни выше, чем у оперированных в фолликулиновую фазу.
Очень весомо исследование H.M.Lemon и J.F.Rodriguez-Sierra (1996), включавшее 5353 больных репродуктивного возраста. Авторы показали, что у больных без поражения лимфатических узлов и оперированных в лютеиновую фазу цикла имеется очень слабая тенденция к повышению (на 5±2%) выживаемости в сравнении с оперированными в фолликулиновую фазу цикла. У больных с поражением лимфатических узлов аналогичное преимущество более выражено (на 34±3%), и находится на пороге статистической значимости (р=0.05).
Исследование не подтвердило влияние на БРВ и ОВ времени проведения операции по отношению к дню овариально-менструального цикла ни у больных ранним РМЖ (T1-2N0M0), ни у больных с поражением регионарных лимфатических узлов (Портной С.М.,1997).
Беременность.
РМЖ, ассоциированный с беременностью, наблюдается в 0,03% случаев среди беременных (Kaiser H.E. et al., 2000) и у 0,2-3,8% больных РМЖ (Wallack M.K. et al., 1983). Под РМЖ, ассоциированным с беременностью, понимается совпадение во времени беременности и выявления РМЖ, либо выявление РМЖ на фоне лактации или не позднее одного года после завершения беременности. Беременность может снижать риск развития РМЖ, а может провоцировать бурное прогрессирование этой опухоли. Потенциальный вред больной женщине от плода связан, прежде всего, с мощным эндокринным влиянием на опухоль. Вред для плода — это чаще всего ятрогенное воздействие, от кюретки гинеколога до химиотерапевтических препаратов; метастатическое поражение плода при РМЖ не описано, хотя при меланоме и лимфоме оно наблюдалось (Potter J.F. и Schoeneman M., 1970).
Трудности при диагностике объективного характера (быстрый рост опухоли, изменение консистенции молочных желёз, осложнения лактации) и субъективного характера (психологическая неготовность к РМЖ больной и врача) приводят к запоздалой диагностике РМЖ, ассоциированного с беременностью, лечение начинается при более распространённой болезни, чем у не беременных (Е.Б.Кампова-Полевая, 1975; Petrek J.A., 1996; Ibrahim E.M. et al., 2000; Wohlfahrt J. et al., 2001).
Как реализуется влияние беременности на течение РМЖ? По данному вопросу в литературе существует некоторое противоречие. Все согласны с тем, что РМЖ, ассоциированный с беременностью, имеет худший прогноз, чем в целом РМЖ. Часть исследователей утверждает, что это обусловлено только большей распространённостью болезни, а в рамках одинаковых стадий течение болезни одинаково (Е.Б.Кампова-Полевая, 1975; Petrek J.A., 1996; Ezzat A. et al., 1996; Gemignani M.L. et al., 1999); другие ученые считают, что даже в рамках одинаковых стадий беременность отягощает прогноз. Как и при анализе любого другого фактора прогноза, вывод будет зависеть от числа наблюдений, длительности прослеженности, точности подбора групп сравнения и качества математического анализа.
Анализ отдалённых результатов лечения рака по материалам Memorial Sloan-Kettering Cancer Center показал, что 10-летняя ОВ больных РМЖ I-IIа стадий, ассоциированным с беременностью, составляет 73%; больных РМЖ, не ассоциированным с беременностью, – 74%. При раке IIIа стадии эти показатели составляют 0% и 35% соответственно (Anderson B.O. et al.,1996).
Результаты РОНЦ им. Н.Н.Блохина РАМН по лечению РМЖ, ассоциированного с беременностью, IIIa-IIIb стадий не хуже результатов лечения РМЖ такой же стадии в целом. 10-летняя безрецидивная выживаемость первых составляет 38±10% (Кампова-Полевая Е.Б. , Портной С.М., 2001), вторых — 31,4±1,9%; (Летягин В.П. и соавт., 1996), однако такой метод сравнения не является самым точным.
Кооперированные исследования, включающие многофакторный анализ, дают более точное представление о проблеме. Международное исследование, основанное на изучении 407 случаев РМЖ в возрасте от 20 до 29 лет, показало, что беременность повышает риск смерти больной в 2,83 раза вне зависимости от размера опухоли и числа поражённых лимфатических узлов. Каждое увеличение интервала между беременностью и выявлением РМЖ на 1 год снижает риск смерти на 15% (Guinee V.F. et al., 1994).
Французское кооперированное исследование провело анализ влияния беременности у 154 больных РМЖ, ассоциированным с беременностью, в сравнении с 308 больными РМЖ, не ассоциированным с беременностью. Показано, что беременность является независимым фактором, достоверно ухудшающим прогноз рака (Bonnier P. et al., 1997).
Кооперированное исследование, проведённое в США с использованием многофакторного анализа, продемонстрировало только слабую тенденцию к повышению риска смерти (1,1) у больных РМЖ, ассоциированным с беременностью, в сравнении с больными раком, не связанным с беременностью (Mueller B.A. et al., 2003).
Повышается ли риск возврата болезни и смерти у больных РМЖ, имевших беременность после радикального лечения? Только Clark R.M. и Chua T. (1989) отмечали ухудшение выживаемости больных, забеременевших в первые 6 месяцев после завершения лечения.
Другие авторы не наблюдали ухудшения выживаемости больных РМЖ, имевших в последующем беременности (Lethaby A.E. et al.,1996; Malamos N.A. et al.,1996; Kroman N. et al.,1997; Velentgas P. et al.,1999; Gelber S. et al., 2001). Mueller B.A. и соавт. (2003) по результатам масштабного исследования (путём многофакторного анализа вычислялся относительный риск смерти у 438 больных РМЖ, имевших роды в сроки более 10 месяцев после лечения рака, в сравнении с 2775 больными РМЖ в возрасте до 45 лет, не имевшими родов) пришли к выводу о том, что последующие роды снижают риск смерти почти в два раза (относительный риск 0,54).
Суждения о минимальном безопасном интервале между лечением РМЖ и наступлением беременности колеблются от 6 месяцев до 5 лет (Petrek J.A., 1996).
Локализация опухоли.
По данным ряда авторов, при центральной локализации опухоли и её небольшом размере возможно успешное лечение с применением органосохраняющих операций (Galimberti V. et al.,1993; Giard S. et al.,1996; Dale P.S. и Giuliano A.E., 1996).
В РОНЦ им. Н.Н.Блохина РАМН сравнивались группы больных с различной локализацией опухоли: внутренней (верхне-внутренний и нижне-внутренний квадранты, граница внутренних квадрантов), центральной (центральный отдел, граница верхних или нижних квадрантов), наружной (верхне-наружный и нижне-наружный квадранты, граница наружных квадрантов и аксиллярный отросток молочной железы). Статистически значимых различий между группами по показателям БРВ и ОВ не наблюдалось (Портной С.М., 1997).
Форма роста опухоли.
Принято выделять следующие формы роста инфильтративного РМЖ: узловая не мультицентричная, узловая мультицентричная, рак Педжета соска без образования опухоли в молочной железе, рак Педжета соска с образованием опухоли в молочной железе, отёчно-инфильтративная (ОИФ).
ОИФ РМЖ (inflammatory breast cancer) клинико-рентгенологически характеризуется диффузным распределением опухолевой ткани в молочной железе по типу инфильтрата (без выявляемого опухолевого узла) и отёком кожи; отличается особой агрессивностью течения, выражающейся в быстром местнорегионарном распространении опухоли по лимфатической системе и быстром развитии отдалённых метастазов.
Местное лечение (оперативное, лучевое, сочетание лучевого с оперативным) отёчно-инфильтративной формы РМЖ даёт 0 — 4 % пятилетней выживаемости при средней длительности жизни от 18 до 22 месяцев (Jaiyesimi I.A. et al.,1992).
Несмотря на проведение профилактической ХТ по схеме CMF и профилактической ЭТ, уже на первом году наблюдений рецидивы и метастазы развиваются в 50% случаев, 3-летняя безрецидивная выживаемость составляет 24%, 5-летняя — 19% (Летягин В.П. и др., 1996).
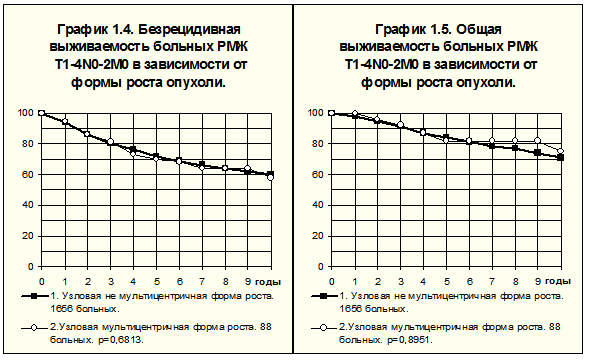
По данным З.О. Зауташвили (1989), отягощение течения болезни при мультицентричном РМЖ возможно только при расположении опухолевых узлов в различных квадрантах молочной железы, а также в случаях, когда соотношение суммарного объёма опухолей к объёму молочной железы превышает обычно наблюдаемое такое соотношение для данного показателя Т.
Из числа вошедших в исследование РОНЦ им. Н.Н.Блохина РАМН больных 88 имели морфологически подтверждённую мультицентричную форму роста РМЖ. При такой форме роста органосохраняющие операции не проводились. Сравнение БРВ и ОВ этих пациенток и больных с узловой немультицентричной формой роста (n=1656) не выявило ухудшения этих показателей при мультицентричном росте (рис. 3).
Симптомы местного распространения первичной опухоли.
Фиксация опухоли к грудной стенке, изъязвление опухоли, отёк и краснота кожи молочной железы существенно отягощают прогноз болезни, что позволило C.Haagensen и A.P.Stout (1942, 1943) отнести эти симптомы к признакам иноперабельности.
Очень подробно прогностическая значимость местных клинических симптомов РМЖ описана Р.А.Керимовым (1989). Автор установил, что отёк и краснота кожи молочной железы — сильные факторы плохого прогноза.
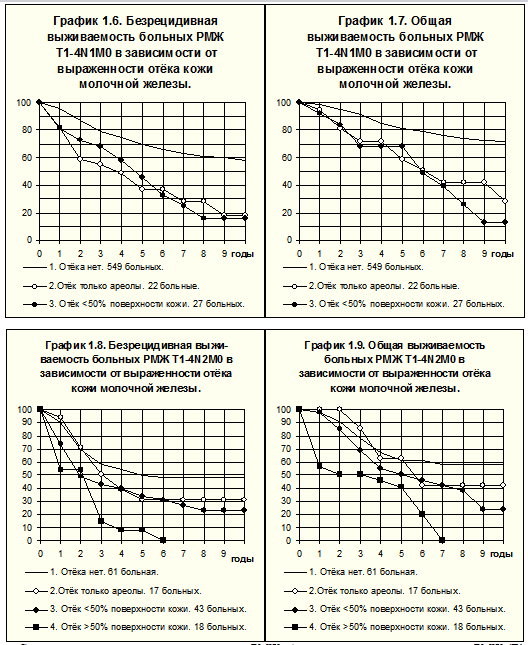
У больных, наблюдаемых нами, отёк кожи был самым частым симптомом местного распространения опухоли. Из 202 больных с клиническими симптомами местного распространения первичной опухоли у 2 наблюдалось врастание опухоли в грудную стенку, у 8 имелось сочетание врастания опухоли в грудную стенку с симптомами поражения кожи и у 192 больных отмечены только признаки поражения кожи молочной железы. Таким образом, у 200 больных былисимптомы распространения опухоли на кожу: отёк кожи (n=156), покраснение кожи (n=21), врастание опухоли в кожу (n=18), изъязвление (n=4), кожные сателлиты (n=1).
Были рассмотрены следующие градации отёка кожи: отёк ограничен только ареолой (n=49), отёк занимает менее 50% поверхности кожи молочной железы (n=81), отёк занимает более 50% поверхности кожи молочной железы (n=26).
У больных с поражением лимфатических узлов, соответствующим N1, отёк кожи, даже если он ограничен ареолой, существенно ухудшает БРВ и ОВ (рис. 4). Различия БРВ и ОВ между группами больных с отёком только ареолы и отёком менее 50% поверхности кожи железы статистически не значимы. Различия в показателях БРВ больных без отёка кожи (1-я группа) статистически значимы по сравнению с имевшими отёк ареолы (2-я группа; р=0.000044) и имевшими отёк, занимающий менее 50% поверхности кожи (3-я группа; р=0.000015). Различия ОВ больных при сравнении 1-й группы со 2-й и 3-й также были статистически значимы (р=0.000278 и р=0.0000056 соответственно).
У пациенток с поражением лимфатических узлов, сопровождающимся формированием конгломератов (N2), по сравнению с больными без отёка кожи наблюдается снижение показателей БРВ и ОВ: при отёке ареолы (различия статистически не значимы), при отёке менее 50% поверхности кожи железы (р=0.015 для БРВ и р=0.048 для ОВ), при отёке более 50% поверхности кожи железы (р=0.000026 для БРВ и р=0.00077 для ОВ). БРВ и ОВ последних были наихудшими по сравнению с показателями других пациенток (р<0.05; рис. 5).
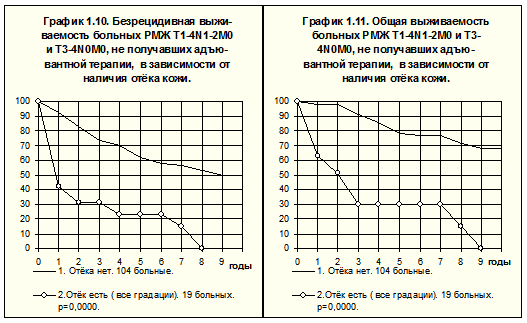
Среди больных с местно-распространённым РМЖ и/или регионарно-распространённым РМЖ (T1-4N1-2M0 + T3-4N0M0), по разным причинам не получавших адъювантной системной терапии, зависимость между отёком кожи молочной железы и течением болезни наиболее демонстративна (рис. 6). БРВ и ОВ пациенток с отёком кожи значительно хуже, чем при отсутствии признаков местного распространения опухоли, (р<0.00001). Частота рецидива болезни за всё время наблюдений была в 2,1 раза выше, а частота смерти — в 3,1 раза чаще у первых, чем у вторых.
Размер опухоли.
Максимальная величина первичной опухоли до начала лечения (далее — размер опухоли) — один из традиционных и сильных факторов прогноза течения РМЖ.
По данным H.Hauser и соавт. (1992), увеличение размера первичной опухоли прямо коррелирует с поражением регионарных лимфатических узлов.
O.Stal и соавт. (1992) показали, что с увеличением размера опухоли увеличивается частота РЭ—— РП—— опухолей, анеуплоидных опухолей.
У больных без признаков местного распространения опухоли, относящихся к Т4, и без метастатического поражения регионарных лимфатических узлов размер опухоли — значимый клинический признак, оказывающий влияние на БРВ больных (Pritchard K.I. et al., 1993). По данным D.Rosner и W.W.Lane (1991), 10-летняя БРВ больных РМЖ c размером опухоли до 0.5 см включительно (T1aN0M0) составила 98%, 0.6-1 см (T1bN0M0) — 94%, 1.1-2 см (T1cN0M0) — 84%, 2.1-5 см (T2N0M0) -71% (р=0.0002).
По данным других многочисленных исследований, размер первичной опухоли является одним из сильнейших независимых клинических факторов прогноза при РМЖ I — III стадий (Cascinelli N. et al., 1987; Fisher E.R. et al., 1990; Rosen P.P. et al., 1991; Aaltomaa S. et al., 1993; Tubiana-Hulin M. et al., 1993; Whelan T. et al., 1994; Norden T. et al., 1994; Nab H.W. et al., 1995; Arriagada R. et al., 1996).
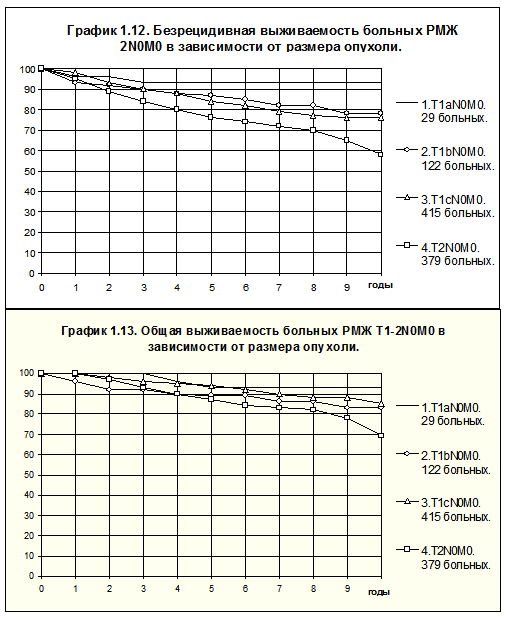
Отчетливое представление о влиянии размера опухоли на течение болезни можно получить при анализе БРВ и ОВ больных без признаков распространения опухоли на грудную стенку и кожу, без поражения регионарных лимфатических узлов у пациенток с различным размером опухоли (рис. 7).
Пяти- и десятилетняя БРВ больных РМЖ T1aN0M0 составила 93±5% (в обоих случаях), T1bN0M0 — 87±3 и 78±5%, T1cN0M0 — 84±2 и 76±3%, T2N0M0 — 76±2 и 58±4% , T3N0M0 — 83±11 и 69±16% соответственно. Статистически достоверны различия при сравнении групп больных РМЖ: T1aN0M0 и T2N0M0 (р = 0,006568; T1bN0M0 и T2N0M0 (р=0.01214); T1сN0M0 и T2N0M0 (р=0.0011).
ОВ больных РМЖ T1aN0M0 в течение 5 и 10 лет составила 92±6 и 92±6%, T1bN0M0 — 89±3 и 83±5%, T1cN0M0 — 94±1 и 85±3%, T2N0M0 — 87±2 и 69±4%, T3N0M0 — 83±11 и 66±17% соответственно. Статистически достоверны различия между группами больных РМЖ при T1aN0M0 и T2N0M0 (р=0.04643), T1сN0M0 и T2N0M0 (р=0.00018).
Слабее зависимость отдаленных результатов лечения у больных с поражением лимфатических узлов, соответствующим N1 или N2 от размера опухоли (Портной С.М., 1997).
Состояние регионарных лимфатических узлов.
Несмотря на множество вновь предложенных для прогнозирования течения РМЖ факторов, поражение подмышечных лимфатических узлов и их число остаются одними из наиболее важных и влияющих на БРВ и ОВ больных.
Частота поражения лимфатических узлов прямо коррелирует с размером первичной опухоли: у больных с непальпируемой опухолью поражение наблюдается в 22% случаев, у больных с пальпируемой — в 41%, и только 6% больных с размером опухоли до 10 мм имели метастазы в лимфатических узлах (Ranaboldo C.J. et al., 1993). По данным H.Hauser и соавт. (1992), метастатическое поражение лимфатических узлов наблюдалось при Т1 в 23%, при Т2 в 47%, при Т3 в 77% и при Т4 в 86% случаев.
Больные с метастазами в лимфатических узлах, особенно в 4-х и более, чаще имели РЭ- опухоли, анеуплоидные (ДНК) опухоли и опухоли с активно пролиферирующими клетками (с высокой доля клеток в S-фазе; Stal O. et al., 1992).
Таким образом, поражение лимфатических узлов существенно ухудшает прогноз болезни и является одним из наиболее значимых прогностических факторов (Cascinelli N. et al., 1987; Joensuu H. et al., 1992; Stal O. et al., 1992; Aaltomaa S. et al., 1993; Tubiana-Hulin M. et al., 1993). У больных с метастазами в подмышечных лимфатических узлах большое значение для прогноза имеет число поражённых лимфатических узлов (McCready D.R. et al., 1993; Arriagada R. et al., 1996). Для больных РМЖ T1-3N1M0, умерших на протяжении первых 2-х лет заболевания, одним из самых сильных факторов прогноза была высокая частота поражения 4-х и более лимфатических узлов (Gilchrist K.W. et al., 1993).
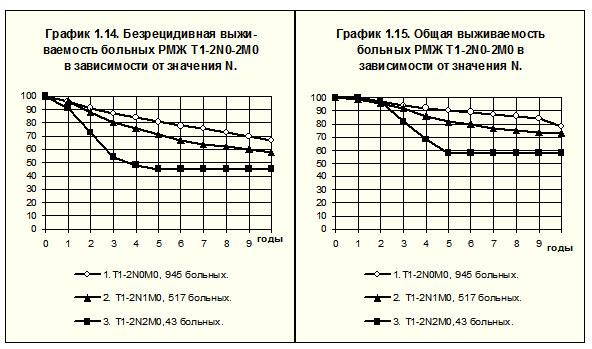
Данные РОНЦ им. Н.Н.Блохина РАМН подтверждают высокую прогностическую значимость факта поражения лимфатических узлов при РМЖ. Влияние степени поражения регионарных лимфатических узлов на течение РМЖ демонстрирует рис. 8, на котором представлены сведенияо БРВ и ОВ 1505 больных с первичными опухолями, соответствующими Т1-Т2. Первую группу составили 945 больных РМЖ T1-2N0M0, из них 278 (29%) пациенток получали адъювантную системную терапию, а 667 (71%) не получали такого лечения. Во 2-ю группу были включены 517 больных РМЖ T1-2N1M0, из которых 430 (83%) получали адъювантную системную терапию, а 87 (17%) по разным причинам такого лечения не получали. Третью группу составили 43 больные РМЖ T1-2N2M0, из них 36 (84%) получали адъювантную системную терапию, а 7 (16%) не получали.
Несмотря на выраженное несоответствие между 1-й и 2-й и между 1-й и 3-й группами в частоте проведения системной терапии, очевидно влияние поражения лимфатических узлов и степени их поражения на течение болезни. Различия БРВ и ОВ между всеми группами статистически значимы. При грубом подсчете частоты рецидивов за все время наблюдений оказалось, что во 2-й группе она была в 1.3 больше, а в 3-й — в 2 раза больше, чем в 1-й. Подсчёт частоты смертей в группах показал ещё большие различия: во 2-й группе она была в 1.5, а в 3-й — в 2.7 раза выше, чем в 1-й.
На рис. 9 представлены БРВ и ОВ больных РМЖ Т1-Т2, не получавших адъювантной системной терапии. Сравнение показателей в группах больных без поражения и с поражением регионарных лимфатических узлов, соответствующим N1, позволяет отметить большее расхождение кривых БРВ и ОВ, чем на рис. 8; различия показателей между группами статистически значимы. При N1 частота рецидива болезни за все время наблюдений была в 1.7, а частота смерти в 1.6 раза выше, чем при N0.
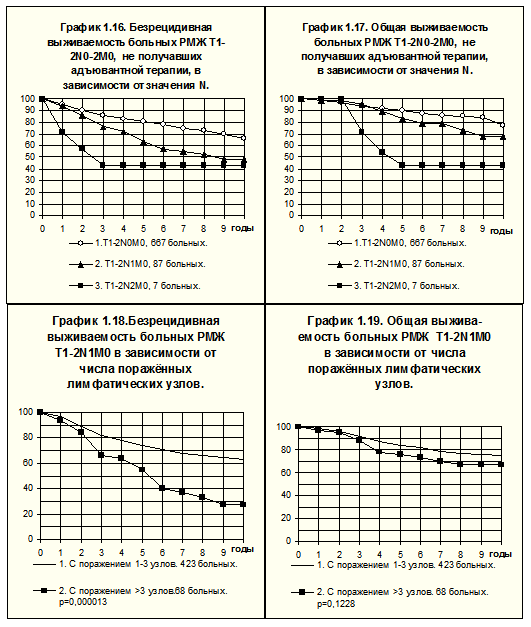
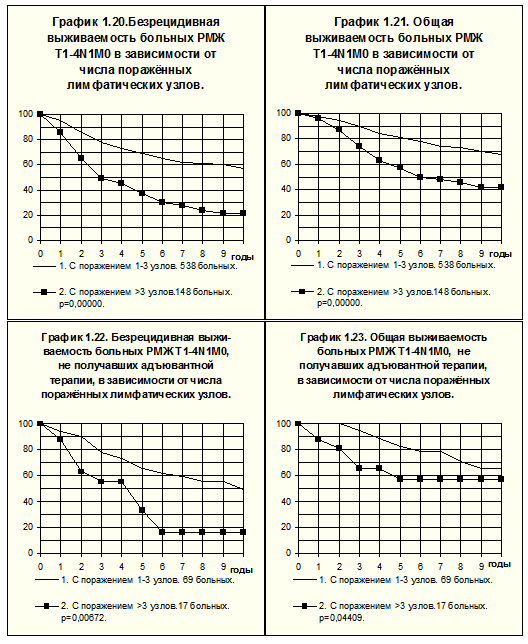
Прогностическое значение числа поражённых регионарных лимфатических узлов для прогноза болезни у больных РМЖ T1-2N1M0 демонстрирует рис.10. Различия БРВ статистически значимы (р=0.000013), частота рецидива заболевания при поражении 4-х и более лимфатических узлов в 1.9 раза выше, чем при поражении 1-3-х лимфатических узлов. Различия ОВ менее выражены и статистически не значимы (р=0,1228).
Аналогичным образом сравнить БРВ и ОВ больных РМЖ T1-4N1M0 позволяет рис. 11. Различия между группами больных высоко достоверны и по БРВ, и по ОВ (р<0,00001).
У больных РМЖ T1-4N1M0, не получавших адъювантной системной терапии, БРВ и ОВ значительно ниже в группе пациенток с 4-я и более поражёнными лимфатическими узлами по сравнению с теми, у которых были поражены 1-3 лимфатических узла (рис. 12). Частота рецидива болезни за всё время наблюдений у первых была в 1.66 раза, а частота смерти — в 1.5 раза выше, чем у вторых.
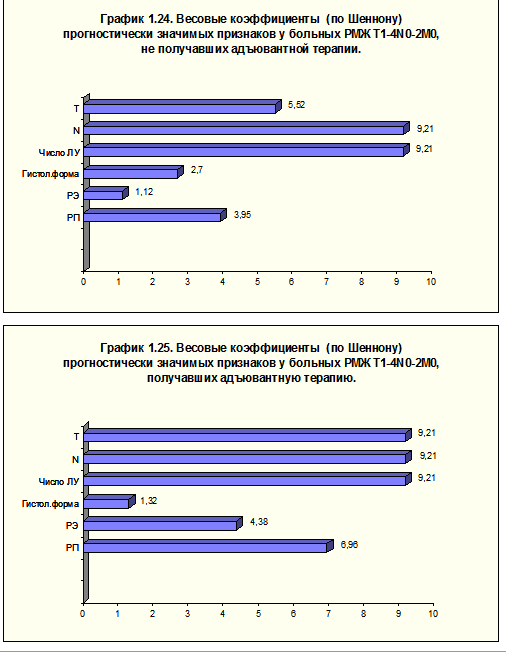
При многофакторном анализе признаков (гистологическая форма, уровни РЭ и РП, число поражённых лимфатических узлов, критерии N и Т) у больных, не получавших адъювантной терапии, самыми сильными признаками оказались характеристики поражения регионарных лимфатических узлов (рис. 13, а).
В случае проведения адъювантной системной терапии число поражённых лимфатических узлов и показатель N оставались в числе самых значимых признаков, с ними также сравнялся показатель Т (рис. 13, б).
Состояние костей.
Кости — одна из самых частых локализаций отдалённых метастазов РМЖ (Холдин С.А., 1962). С этим связана необходимость скрининга метастатического поражения костей посредством радионуклидного сканирования. Поражение кости опухолевыми клетками начинается с костного мозга, детекция клеток РМЖ в костном мозге с помощью иммунофлуоресцентных моноклональных антител (самым чувствительным методом) имеет значение фактора плохого прогноза (Mansini J.L. et al., 1987; Osborne M.P. et al., 1989; Diel I.J. et al., 1995).
Возникает вопрос: может ли нарушение равномерности накопления радионуклида в костях у больных РМЖ приводить к ухудшению течения болезни и, следовательно, считаться фактором плохого прогноза? В РОНЦ им. Н.Н.Блохина РАМН был проведен следующий анализ.
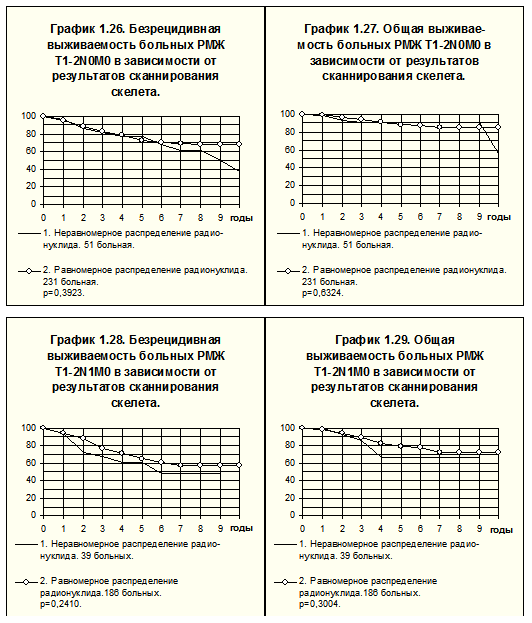
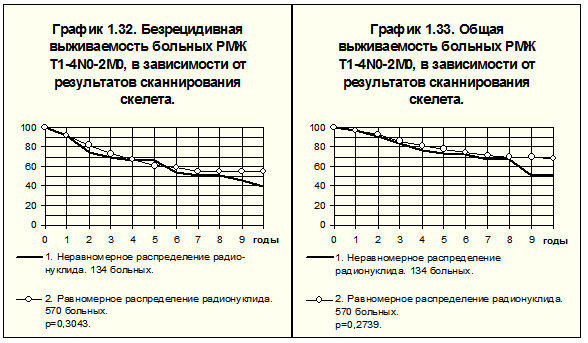
Радионуклидные исследования осуществляли в лаборатории радиоизотопной диагностики, рентгенологические — в рентгенодиагностическом отделении РОНЦ им. Н.Н.Блохина РАМН. Сканирование скелета произведено 704 больным РМЖ I-III стадий, у 570 больных отмечено равномерное распределение радионуклида, у 134 (19%) — неравномерное накопление радионуклида (заключения специалистов по радионуклидной диагностике — диффузно-неравномерное или очаговое накопление). Больным последней группы проводили дополнительное рентгенологическое исследование участков скелета, имеющих диффузно-неравномерное или очаговое накопление радионуклида, при котором признаков метастатического поражения костей обнаружено не было (больные с выявленными метастазами в костях в данный анализ не включены). Частота таких симптомов составила: при T1-2N0M0 — 18% (у 51 из 282 больных), T1-2N1M0 — 17% (у 39 из 225 больных), T3-4N0-2M0 и T1-2N2M0 — 22% (у 44 из 197 больных).
Нарушение распределения радионуклида в костях статистически значимо не отражается на показателях БРВ и ОВ больных РМЖ T1-2N0M0 (рис. 14), T1-2N1M0 (рис.15), T3-4N0-2М0 и T1-2N2M0 (рис. 16).
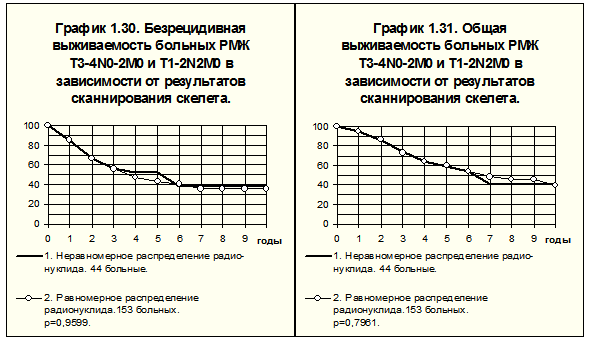
Практически равная процентная представленность неравномерного накопления радионуклида у больных с различной степенью местно-регионарного распространения опухоли позволяет сравнить значение этого симптома в объединённых группах: с неравномерным распределением радионуклида и с равномерным накоплением радионуклида в костях.
В 1-й группе (n=134) РМЖ T1-2N0M0 наблюдался у 51 (38%) больной, T1-2N1M0 — у 39 (29%), РМЖ T3-4N0-2M0 и T1-2N2M0 — у 44 (33%). Во 2-й группе (n=570) РМЖ T1-2N0M0 наблюдался у 231 (40%) больной, T1-2N1M0 — у 186 (33%), T3-4N0-2M0 и T1-2N2M0 — у 153 (27%), т.е. группы вполне сопоставимы.
Рис. 17 демонстрирует БРВ и ОВ больных объединённых групп. Наблюдаются, по существу, идентичные отдалённые результаты. Различия БРВ и ОВ статистически незначимы.
Таким образом, нам удалось показать, что нарушение равномерности накопления радионуклида в костях больных РМЖ при рентгенологическом подтверждении отсутствия метастатического поражения костей не имело статистически значимого прогностического значения.
Источники литературы
Зауташвили З.О. Мультицентрический рак молочной железы. Автореф. дис. … канд. мед. наук. М., 1989.
Кампова-Полевая Е.Б. Рак молочной железы у молодых женщин. Дисс. … к.м.н. Москва, 1975, 239 с.
Кампова-Полевая Е.Б, Портной С.М. Рак молочной железы и беременность. V ежегодная российская онкологическая конференция 27-29 ноября 2001 года, Москва. М. 2001, 9-11.
Керимов Р.А. Клиническая оценка факторов прогноза при III стадии рака молочной железы. Автореф. дис. … канд. мед. наук М., 1989.
Летягин В.П., Лактионов К.П., Высоцкая И.В., Котов В.А. Рак молочной железы. М.,1996, 150.
Портной С.М. Рак молочной железы (факторы прогноза и лечение). Дисс. … д.м.н., Москва, 1997, 306 с.
Семиглазов В.Ф., Ржанков С.В., Мигманова Н.Ш., Кремень Б.В., Бараш Н.Ю. Отдалённые результаты лечения 3359 больных раком молочной железы // Вопросы онкологии. 1983. T. 29, N 12, C. 25-30.
Холдин С.А. Злокачественные опухоли молочной железы // Злокачественные опухоли. Л.,1962, Т.3, Ч.1, С. 31-167.
Aaltomaa S., Lipponen P., Eskelinen M. et al. Comparison of classic and quantitative prognostic factors in hormone receptor-positive and hormone receptor-negative female breast cancer // Am. J. Surg. 993. Vol.165, N 3. P. 307-311.
Anderson B.O., Petrek J.A., Byrd D.R., Senie R.T., Borgen P.I. Pregnancy influences breast cancer stage at diagnosis in women 30 years of age and younger // Ann. Surg. Oncol. 1996. Vol. 3, N 2. P. 204-211.
Arriagada R., Le M.G., Rochard F., Contesso G. Conservative treatment versus mastectomy in early breast cancer: patterns of failure with 15 years of follow-up data // J. Clin. Oncol. 1996 Vol. 14, N 5. 1558-1564.
Badwe R.A., Gregory W.M., Chaudary M.A. et al. Timing of surgery during menstrual cycle and survival of premenopausal women with operable breast cancer // Lancet. 1991. Vol. 337, N 8752. P. 1261-1264.
Bonadonna G., Valagussa P., Rossi A. et al. Ten-year experience with CMF-based adjuvant chemotherapy in resectable breast cancer // Breast Cancer Res. Treat. 1985. N 5. P. 95-115.
Bonnier P., Romain S., Dilhuydy J.M. et al. Influence of pregnancy on the outcome of breast cancer: a case-control study // Int. J. Cancer. 1997. Vol. 72, N 5. P. 720-727.
Cascinelli N., Greco M., Bufalino R. et al. Prognosis of breast cancer with axillary node metastases after surgical treatment only // Eur. J. Cancer Clin. Oncol. 1987. Vol. 23, N 6. P. 795-799.
Clark R.M., Chua T. Breast cancer and pregnancy: the ultimate challenge // Clin. Oncol. 1989. N 1. P. 11.
Dale P.S., Giuliano A.E. Nipple-areolar preservation during breast-conserving therapy for subareolar breast carcinomas // Arch. Surg. 1996. Vol. 131, N 4, 430-433.
Diel I.J., Kaufmann M., Solomayer E.F. et al. Micrometastatic tumor cells in bone marrow versus nodal status in breast cancer: impact on prognosis in 727 patients with primary breast cancer // Adjuvant Therapy of Primary Breast Cancer. 5-th Internationational Conference. March 1 — 4 , 1995. St.Gallen. Switzerland. Anti-Cancer Drugs. An International Journal on Anti-Cancer Agents. 1995. Vol.6, Suppl. 2. P. 56-57.
Early Breast Cancer Trialists’ Collaborative Group. Polychemotherapy for early breast cancer: an overview of the randomized trials // Lancet. 1998. Vol. 352, N 9132. 930-942.
Ezzat A., Raja M.A., Berry J. et al. Impact of pregnancy on non-metastatic breast cancer: a case control study // Clin. Oncol. 1996. Vol. 8, N 6. 367-370.
Fisher B., Redmond C., Legault-Poisson S. et al. Postoperative chemotherapy and tamoxifen compared with tamoxifen alone in the treatment of positive node breast cancer patients aged 50 years and older with tumors responsive to tamoxifen: Results from the National Surgical Adjuvant Breast and Bowel Project B-16 // J. Clin. Oncol. 1990. Vol. 8, N 6. 1005 — 1018.
Fisher E.R., Redmond C, Fisher B. et al. Pathologic findings from the National Surgical Adjuvant Breast and Bowel Projects (NSABP): prognostic discriminants for 8-year survival for node-negative invasive breast cancer patients // Cancer. 1990. Vol. 65, N 9, Suppl. P. 2121-2128.
Focan C., Beauduin M., Salamon E. et al. High-dose medroxyprogesterone acetate (HDMPA) as adjuvant hormonotherapy for early breast cancer. Importance of age, menopausal and nodal status as prognostic determinants. Ten years results of a multicenter randomized trial // Anticancer Res. 1995. Vol. 15, N 5A. P. 1716-1717.
Fowble B.L., Schultz D.J., Overmoyer B. et al. The influence of young age on outcome in early stage breast cancer // Int. J. Radiat. Oncol. Biol. Phys. 1994. Vol. 30, N1. P. 23-33.
Galimberti V., Zurrida S., Zanini V. Central small size breast cancer: how to overcome the problem of nipple and areola involvement // Eur. J. Cancer. 1993. Vol. 29A, N 8. P. 1093-1096.
Gelber S., Coates A.S., Goldhirsch A. et al. Effect of pregnancy on overall survival after the diagnosis of early-stage breast cancer // J. Clin. Oncol. 2001. Vol. 19, N 6. P. 1671-1675.
Gemignani M.L., Petrek J.A., Borgen P.I. Breast cancer and pregnancy // Surg. Clin. North. Am. 1999. Vol. 79, N 5. P. 1157-1169.
Giard S., Vanderstichele S., Coche B., Laurent J.C. [Conservative surgical treatment of retro-areolar breast tumors. Local control and aesthetic results] // J. Gynecol. Obstet. Biol. Reprod. (Paris) 1996. Vol. 25, N 3. P. 238-241.
Gilchrist K.W., Gray R., van Driel-Kulker A.M., et al. High DNA content and prognosis in lymph node positive breast cancer. A case control study by the University of Leiden and ECOG (Eastern Cooperative Oncology Group) // Breast Cancer Res. Treat. 1993. Vol. 28, N 1. P. 1-8.
Gnant MF, Seifert M, Jakesz R, et al. Breast cancer and timing of surgery during menstrual cycle: a 5-year analysis of 385 pre-menopausal women // Int. J. Cancer. 1992. Vol. 52, N 5. P. 707-712.
Guinee VF, Olsson H, Moller T, et al. Effect of pregnancy on prognosis for young women with breast cancer // Lancet. 1994. Vol. 343 N 8913. P. 1587-1589.
Haagensen C., Stout A.P. Carcinoma of the breast. I — Results of treatment // Ann. Surg. 1942. Vol. 116. P. 801 — 815.
Haagensen C., Stout A.P. Carcinoma of the breast. II — Criteria of operability // Ann. Surg. 1943. Vol. 118. P. 859-870 & 1032-1051.
Hauser H., Beham A., Steindorfer P. et al. [Breast cancer in the Catchment area of the Graz institute of pathology. Evaluation of morphologic parameters based on 1510 cases.] // Wien. Klin. Wochenschr. 1992. Vol. 104, N 23. P. 717-720.
Ibrahim EM, Ezzat AA, Baloush A, et al. Pregnancy-associated breast cancer: a case-control study in a young population with a high-fertility rate // Med. Oncol. 2000. Vol. 17., N 4. P. 293-300.
Jager W., Sauerbrei W. Effect of timing of surgery during the menstrual cycle of premenopausal breast cancer patients // Breast Cancer Res. Treat. 1995. Vol. 34, N 3. P. 279-287.
I.A.Jaiyesimi, A.U.Buzdar, G.Hortobagyi. Inflammatory breast cancer: a review // J.Clin.Oncol. 1992. Vol. 10. P. 1014-1024.
Joensuu H., Toikkanen S. Identification of subgroups with favourable prognosis in breast cancer // Acta Oncol. 1992. Vol. 31, N 3. P. 293-301.
Kaiser H.E., Nawab E., Nasir A., Chmielarczyk W., Krenn M. Neoplasms during the progression of pregnancy // In Vivo. 2000. Vol. 14, N 1. P. 277-285.
Kroman N.T., Hjgaard A.D., Andersen K.W., et al. [Menstrual cycle and surgery of breast cancer. Point of time for the surgery of primary breast cancer in connection with menstrual cycle is without prognostic significance] // Ugeskr. Laeger. 1995. Vol. 157, N 43. P. 5989-5993.
Kroman N., Jensen M.B., Melbye M., Wohlfahrt J., Mouridsen H.T. Should women be advised against pregnancy after breast-cancer treatment? // Lancet. 1997. Vol. 350, N 9074. P. 319-322.
Kurtz J.M., Spitalier J.-M., Amalric R. et al. Mammary recurrences in women younger than forty // Int. J. Radiat. Oncol. Biol. Phys. 1988. Vol. 15, N 2. P. 271-276.
Law T.M., Hesketh P.J., Porter K.A. et al. Breast cancer in elderly women: presentation, survival, and treatment options // Surg. Clin. North. Am. 1996. Vol. 76, N 2. P. 289-308.
Lemon H.M., Rodriguez-Sierra J.F. Timing of breast cancer surgery during the luteal menstrual phase may improve prognosis // Nebraska Med. J. 1996. Vol. 81, N 4. P. 110-115.
Lethaby A.E., Mason B.H., Holdaway I.M., Kay R.G. Age and ethnicity as prognostic factors influencing overall survival in breast cancer patients in the Auckland region. Auckland breast cancer study group // N. Z. Med. J. 1992. Vol. 105, N 947. P. 485-488.
Lethaby A.E., O’Neill M.A., Mason B.H. et al. Overall survival from breast cancer in women pregnant or lactating at or after diagnosis // Int. J. Cancer. 1996. Vol. 67, N 6. P. 751-755.
Levine M., Myles J., Shepherd L., et al. Optimal timing of breast cancer surgery within the menstrual cycle: results from a prospective trial // Proc. Annu. Meet. Am. Soc. Clin. Oncol. 1996. Vol. 15 A61.
Lyman G.H., Lyman S.L., Balducci L. et al. Age and the risk of breast cancer recurrence // Proc. Annu. Meet. Am. Soc. Clin. Oncol. 1994. N 13, A101.
Malamos N.A., Stathopoulos G.P., Keramopoulos A., Papadiamantis J., Vassilaros S. Pregnancy and offspring after the appearance of breast cancer // Oncology. 1996. Vol. 53, N 6 P. 471-475.
Mansini J.L., Berger U., Easton D., et al. Micrometastases in bone marrow in patients with primary breast cancer: evaluation as an early predictor of bone metastases // Br. Med. J. 1987. Vol. 295, P. 1093-1096.
McCready D.R., Chapman J.W., Hanna W.M., Mobbs B.G. The importance of considering adjuvant therapy in prognostic investigations of breast cancer // Proc. Annu. Meet. Am. Soc. Clin. Oncol. 1993. N 12. A222.
McGuire W.L., Hilsenbeck S., Clark G.M. Optimal mastectomy timing // J. Nat. Cancer Inst. 1992. Vol. 84, 5. P. 346-348.
Molnar L., Besznyak I., Koves I. Cancer of the breast in young women // Acta Chir. Hung. 1995. Vol. 35, N 1-2. P. 5-11.
Mueller B.A., Simon M.S., Deapen D., Kamineni A., Malone K.E., Daling J.R. Childbearing and survival after breast carcinoma in young women // Cancer. 2003. Vol. 98, N 6. P. 1131-1140.
Nab H.W., Kluck H.M., Rutgers E.J. et al. Long-term prognosis of breast cancer: an analysis of 462 patients in a general hospital in South East Netherlands // Eur. J. Surg. Oncol. 1995. Vol. 21, N 1. P. 42-46.
Namer M., Abbes M., Ramaioli A., et al. Influence of age on the characteristics and the outcome of 2023 breast cancer patients // Proc. Annu. Meet. Am. Soc. Clin. Oncol. 1993. N 12. A29.
Nathan B., Bates T., Anbazhagan R. et al. Timing of surgery for breast cancer in relation to the menstrual cycle and survival of premenopausal women // Br. J. Surg. 1993. Vol. 80, N 1. P. 43.
Neff P.T., Bear H.D., Pierce C.V. et al. Long-term results of breast conservation therapy for breast cancer // Ann. Surg. 1996. Vol. 223, N 6. P. 709-716.
Norden T., Lindgren A., Bergstrom R., Holmberg L. Defining a high mortality risk group among women with primary breast cancer // Br. J. Cancer. 1994. Vol. 69, N 3. P. 520-524.
Osborne M.P., Asina S., Wong G.Y., et al. Immunofluorescent monoclonal antibody detection of breast cancer in bone marrow: Sensitivity in a model system // Cancer Res. 1989. Vol. 49. P. 2510-2513.
Petrek J.A. Breast cancer and pregnancy In: Harris JR, Morrow M, Lippman ME, et al., eds. Diseases of the Breast. Lippincott-Raven Publishers: Philadelphia, Pa, 1996. P. 883-892.
PotterJ.F., Schoeneman M. Metastases of maternal cancer to the placenta and fetus // Cancer. 1970. Vol. 25. P. 380.
Pritchard K.I., Trudeau M.E., Chapman J.W. et al. Prognostic variables in node-negative breast cancer: an all subset analysis // Proc. Annu. Meet. Am. Soc. Clin. Oncol. 1993. N 12. A73.
Ranaboldo C.J., Mitchel A., Royle G.T. et al. Axillary nodal status in women with screen-detected breast cancer // Eur. J. Surg. Oncol. 1993. Vol. 19, N 2. P. 130-133.
de la Rochefordiere A., Asselain B., Campana F. et al. Age as prognostic factor in premenopausal breast carcinoma // Lancet. 1993. Vol. 341, N 8852. P. 1039-1043.
Rosen P.P., Groshen S., Kinne D.W. Prognosis in T2N0M0 stage I breast carcinoma: a 20-year follow-up study // J. Clin. Oncol. 1991. Vol. 9, N 9. P. 1650-1661.
Rosner D., Lane W.W. Clinical determination for adjuvant therapy in axillary node-negative (ANN) breast cancer patients — ten-year follow-up // Breast Cancer Res. Treat. 1991. Vol. 19, N 2 P. 212.
Senie R.T., Rosen P.P., Rhodes P. et al. Timing of breast cancer excision during the menstrual cycle influences duration of disease-free survival // Ann. Intern. Med. 1991. Vol. 115, N 5. P. 337-342.
Stal O., Brisfors A., Carstensen J. et al. Relationships of DNA ploidy, S-phase fraction and hormone receptor status to tumor stage in breast cancers detected by population screening. The South-East Sweden Breast Cancer Group // Int. J. Cancer. 1992. Vol. 51, N 1. P. 28-33.
Tubiana-Hulin M., Le Doussal V., Hacene K., Rouesse J., Brunet M. Sequential identification of factors predicting distant relapse in breast cancer patients treated by conservative surgery // Cancer. 1993. Vol. 72, N 4. P. 1261-1271.
Velentgas P., Daling J.R., Malone K.E., Weiss N.S., Williams M.A., Self S.G., Mueller B.A. Pregnancy after breast carcinoma: outcomes and influence on mortality // Cancer. 1999. Vol. 85, N 11. P. 2424-2432.
Veronesi U., Luini A., Mariani L. et al. Effect of menstrual phase on surgical treatment of breast cancer // Lancet. 1994. Vol. 343, N 8912. P. 1545-1547.
Wallack M.K., Wolf J.A. Jr., Bedwinek J. et al. Gestational carcinoma of the female breast // Curr. Probl. Cancer. 1983. Vol. 7. P. 1.
Whelan T., Clark R., Roberts R. et al. Ipsilateral breast tumor recurrence postlumpectomy is predictive of subsequent mortality: results from a randomised trial. Investigators of the Ontario Clinical Oncology Group // Int. J. Radiat. Oncol. Biol. Phys. 1994. Vol. 30, N 1. P. 11-16.
Wohlfahrt J., Andersen P.K., Mouridsen H.T., Melbye M. Risk of late-stage breast cancer after a childbirth // Am. J. Epidemiol. 2001. Vol. 153, N 11 P. 1079-1084.