Под местно-распространенным раком молочной железы (МР РМЖ)* понимается рак III стадии.
Несмотря на некоторое сокращение доли рака III стадии среди вновь выявляемых случаев болезни в России (с 26,6 в 1990 г. до 25,8% в 2010 г., абсолютное число таких больных за 30 лет выросло более чем в 2 раза (от 6 118 до 14 938 случаев в год) (см. гл. «Статистика рака молочной железы в России»).
Клиническая и биологическая характеристика
Из определения МР РМЖ, очевидно, что это – «большая» болезнь.
Местно-распространенный РМЖ – системная болезнь, причем системная в большей степени, чем ранний рак молочной железы. Рак I стадии по концепции B. Fisher расценивается как системная болезнь, хотя это справедливо только на 30%, у 70% больных болезнь не метастазирует после местного лечения. Системность РМЖ можно оценить количественно, например, по показателю частоты рецидивов за 10 лет среди больных, не получавших системной терапии. Увеличение опухоли в размерах, появление признаков распространения опухоли на кожу, поражение лимфатических узлов, все это – факторы, повышающие вероятность наличия диссеминированных микрометастазов и системность болезни (табл. 1).
Наличие отека кожи у больных без системной терапии сопровождается десятилетней безрецидивной выживаемостью, равной 0%. Судьба этих больных свидетельствует о том, что с появлением отека кожи молочной железы рак становится системной болезнью на 100% и его лечение невозможно без системной терапии [1].
Таблица 1
Вероятность рецидива рака молочной железы после местного лечения по данным РОНЦ им. Н. Н. Блохина РАМН [1]
| Группы больных (без адъювантной системной терапии) | Вероятность рецидива болезни за 10 лет |
| T1-2N0M0 | 34% |
| T1-2N1M0 | 52% |
| T1-2N2M0 | 57% |
| T4 (отек кожи) N0-3M0 | 100% |
«Быстрая болезнь». Отдаленные метастазы развиваются из невыявляемых при первичном обследовании микрометастазов, причем, если у больных с отдаленными метастазами ретроспективно анализировать сроки реализации микрометастазов в метастазы, оказывается, что при раке III стадии это происходит быстрее, чем при раке I и II стадий. Так, по нашим данным, метастазы в печени выявлялись при раке III стадии в среднем через (21,4±4,8) мес, а при раке II стадии – через (36,8±7,3) мес [2]; медиана выявления метастазов в костях при раке III стадии составила 1,6 года, а при раке I стадии – 3,5 года [3]. Прямая зависимость между исходной стадией рака и скоростью появления клинически выявляемых метастазов наводит на мысль, что микрометастазы у больных раком III стадии исходно имеют больший объем или быстрее растут, или и то, и другое.
МР РМЖ — не только системная болезнь, для него характерна высокая частота местно-регионарных рецидивов. Этим обусловлена необходимость проведения местного лечения, — операции и лучевой терапии. Если после системной терапии достигается полный клинический эффект, и больная не получает местного лечения, как правило, первый рецидив болезни наблюдается в молочной железе. Если местное лечение проводится не в полном объеме, вероятность местно-регионарных рецидивов возрастает.
Baillet et al. [4] лечили больных местно-распространенным РМЖ (n = 134, из них только 27 больных имели Т4) с применением предоперационной ХТ (винбластин 6 мг/м2, тиофосфамид 6 мг/м2, метотрексат 25 мг/м2, 5-фторурацил 350 мг/м2 и адриамицин 30 мг/м2 внутривенно каждые 10 дней в течение 2 мес), лучевой терапии (наружное облучение 23 Гр за 4 фракции+внутритканевая терапия с использованием 192Ir в дозе 20-30 Гр). Адъювантную ХТ осуществляли по прежней схеме на протяжении 12-18мес (введение адриамицина прекращали по достижении суммарной дозы 400 мг/м2). Операцию проводили только в случаях местно-регионарного рецидива. Пяти- и десятилетняя выживаемость составила 64 и 50% соответственно. Местно-регионарный рецидив наблюдался у 20% больных.
Другие попытки избежать операции были менее удачны. D.B. McLaren et al. [5] провели ретроспективный анализ результатов лечения 91 больной МР РМЖ, из которых 2/3 имели Т4 и/или поражение лимфатических узлов. Предоперационная ХТ (по различным схемам) была эффективна в 61% случаев, дополнительная лучевая терапия повышала частоту эффекта до 93% (в том числе 56% случаев полного эффекта), однако мастэктомия была выполнена только 31% пациенток. Пяти- и десятилетняя БРВ составили 18 и 8%, пяти- и десятилетняя ОВ — 28 и 11% соответственно. Возврат болезни в 31% случаев проявлялся развитием местного рецидива и в 15% — одновременным развитием местного рецидива и отдаленных метастазов.
Buric et al. [6] приводят результаты консервативного лечения 30 больных отечно-инфильтративной формой РМЖ. Лечение включало 3 курса ХТ по схеме FAC (циклофосфан 500 мг/м2 + адриамицин 50 мг/м2 + 5-фторурацил 500 мг/м2) с интервалом 4 нед, затем лучевую терапию и еще 3 курса ХТ по схеме FAC. Через 1-32мес у 22 (73%) пациенток наблюдалось местное прогрессирование болезни, отдалённые метастазы были первым проявлением диссеминации у 7 больных. Ретроспективный анализ результатов лечения 1 896 больных МР РМЖ в РОНЦ им. Н.Н. Блохина РАМН показал, что включение операции в комплекс лечебных мероприятий сопровождается более высокими показателями БРВ — 5-летняя — (47,4±1,3) и 10-летняя — (35,8±1,5) по сравнению с пациентками, получавшими только консервативное лечение — 5-летняя — (26,4±3,0) и 10-летняя — (17,2±3,2); p <0,01 [7]. Таким образом, проведение лучевой терапии в самостоятельном варианте уступает по эффективности сочетанию «операция + лучевая терапия».
Из методов местного лечения одной операции также недостаточно, для эффективного местного контроля болезни необходимо проведение лучевой терапии перед операцией или после нее. Более того, при воспалительной форме болезни вполне оправданно повышение суммарной дозы до 60-66 Гр. По материалам РОНЦ им. Н.Н. Блохина РАМН было показано, что при отечно-инфильтративной форме рака (первичная отечно-инфильтративная форма или узловая форма со вторичным отеком> 50% кожи) частота местно-регионарного рецидива составила 43% (3/7) у больных, получивших лучевую терапию в СОД 40 Гр, и 5% (2/39) у пациентов с СОД 60-70 Гр (р < 0,05) [8]. По данным University of Texas M.D. Anderson Cancer Center: у больных первичной отечно-инфильтративной формой рака повышение СОД при проведении послеоперационной лучевой терапии от 60 до 66 Гр существенно улучшало местно-регионарный контроль болезни в случаях, когда эффект от предоперационной химиотерапии был меньшим, чем частичный эффект; с позитивными или неизученными краями резекции и при возрасте менее 45 лет [9].
Биологические особенности. По сравнению с ранним РМЖ при местно-распространенном раке возрастает частота опухолей с неблагоприятным прогнозом и снижается частота относительно благоприятных характеристик. Так, по данным РОНЦ им. Н.Н. Блохина РАМН [1], частота редких морфологических форм рака с относительно доброкачественным течением (слизистый, папиллярный, тубулярный и медуллярный) при раннем раке (T1-2N0M0) составляет 11%, а при местно-распространенном раке — 2%. Диплоидные и тетраплоидные опухоли (самая хорошая прогностическая характеристика) при раке I стадии наблюдались в 44%, а при раке III стадии — в 20%; доля анеуплоидных многоклоновых опухолей (самая плохая прогностическая характеристика) составила 3 и 17% соответственно (табл. 2).
Таблица 2
Стадия рака молочной железы по системе TNM и плоидность опухоли [1]
|
Стадия рака и число больных |
Частота диплоидных и анеуплоидных опухолей при различных стадиях РМЖ, % |
||
|
диплоидные* и тетраплоидные** |
анеуплоиные не тетраплоидные*** |
анеуплоидные многоклоновые |
|
| I (n = 64) | 44 | 53 | 3 |
| II (n = 112) | 38 | 57 | 5 |
| III (n = 92) | 20 | 63 | 17 |
| Всего (n = 268) | 33 | 58 | 9 |
Примечание: * — индекс плоидности ДНК 1,0-1,09; ** — индекс плоидности ДНК 1,85-2,15; *** — индекс плоидности ДНК <1,0; 1,10 — 1,84; >2,15.
По некоторым данным при отечно-инфильтративной форме возрастает частота опухолей с гиперэкспрессией HER2/neu до 38-48% [10, 11].
Лечение
Оценка операбельности
Разработка проблемы операбельности РМЖ связана с именем C. Haagensen, причем освещение проблемы с каждой последующей публикацией углублялось. В 1943 г. C. Haagensen & A. Stout были предложены критерии иноперабельности [12], в 1956 г. проблема была изложена более широко [13], в 1965 г. помимо всестороннего изложения проблемы было дано определение операбельности: операбельность при раке молочной железы подразумевает не просто техническую возможность полного удаления опухоли, но возможность достижения с помощью операции стойкого местно-регионарного контроля болезни [14].
Чрезвычайно интересно посмотреть, как вырабатывались критерии иноперабельности, какие клинические признаки имели наибольшее влияние на прогноз болезни. Важно отметить, что в то время больные (1 135 радикальных мастэктомий, выполненных в Presbyterian Hospital 1915-1942 гг.) после операции не получали адъювантной терапии, и влияние признаков можно было оценить в чистом виде. Как видно из табл. 3 и 4, признаки иноперабельности были абсолютными (категорическими) и относительными (серьезными).
Таблица 3
Критерии иноперабельности. Признаки абсолютной иноперабельности [13]
| Признаки категорической иноперабельности | n | Частота местных рецидивов за 5 лет, % | 5-летнее выздоров-ление, %. |
| Распространенный (> 1/3) отек кожи молочной железы | 51 | 60,8 | 0 |
| Сателлиты на коже молочной железы | 7 | 57,1 | 0 |
| Отечно-инфильтративная форма рака | 25 | 60 | 0 |
| Отдаленные метастазы | 10 | 20 | 0 |
| Метастазы в парастернальных или надключичных лимфатических узлах | 16 | 56,2 | 0 |
| Отек руки | 4 | 50 | 0 |
| Всего больных | 77 | 53,2 | 0 |
Примечание: число больных меньше, чем сумма признаков, так как часть больных имела сочетание признаков
Наличие любого из абсолютных признаков иноперабельности сочеталось с 5-летним выздоровлением, равным 0%. Этот показатель у всей группы больных за исключением больных с признаками абсолютной иноперабельности составлял 45,1%. Наличие какого-либо одного из признаков относительной иноперабельности сопровождалось снижением 5-летнего выздоровления до 12,5-37,5%. Сочетание 2 или более признаков относительной иноперабельности приводило к снижению 5-летнего выздоровления до 0-5,3%. В то же время, было показано, что некоторые признаки, несмотря на их грозный вид, не отягощают судьбу больных: мультицентрический рост, размер опухоли более 10 см, краснота кожи и врастание опухоли в кожу [13].
Таблица 4
Критерии иноперабельности. Признаки относительной иноперабельности и признаки, не отягощающие операбельност [13]
| Признак | n | Частота местных рецидивов за 5 лет, % | 5-летнее выздоров-ление, %. | |
| Серьезные признаки (относительнойиноперабельности) | Изъязвление кожи | 14 | 14,3 | 35,7 |
| Изъязвление кожи + ЛДСП | 13 | 30,8 | 0 | |
| 1. Ограниченный (<1/3) отек кожи | 75 | 32 | 22,7 | |
| Ограниченный (<1/3) отек кожи + ЛДСП | 24 | 58,3 | 0 | |
| 2. Фиксация опухоли к грудной стенке | 20 | 40 | 5 | |
| Фиксация опухоли к грудной стенке + ЛДСП | 27 | 37 | 3,7 | |
| 3. Подмышечный метастаз ≥ 2,5 см | 24 | 12,5 | 37,5 | |
| Подмышечный метастаз ≥ 2,5 см + ЛДСП | 19 | 42,1 | 5,3 | |
| 4. Фиксированные подмышечные метастазы | 8 | 12,5 | 12,5 | |
| Фиксированные подмышечные метастазы + ЛДСП | 18 | 50 | 0 | |
| Признаки, не отягчающие операбельность | Опухоль ≥ 10 см | 26 | 11,5 | 42,3 |
| Мультицентричная опухоль | 27 | 25,9 | 51,9 | |
| Краснота кожи | 33 | 21,2 | 42,4 | |
| Врастание в кожу | 58 | 17,2 | 44,8 | |
| Все оперированные больные с исключением больных, имевших признаки категорической иноперабельности | 1 058 | 16 | 45,1 | |
Примечание: ЛДСП – любой другой серьезный признак
Таким образом, клинические признаки иноперабельности были определены:
- Распространенный (> 1/3) отек кожи молочной железы.
- Сателлиты на коже молочной железы.
- Отечно-инфильтративная форма рака
- Метастазы в парастернальных лимфатических узлах.
- Метастазы в надключичных лимфатических узлах.
- Отек руки.
- Отдаленные метастазы.
- Сочетание любых двух или более серьезных признаков:
- изъязвление кожи;
- ограниченный (<1/3) отек кожи;
- фиксация опухоли к грудной стенке;
- подмышечный метастаз ≥ 2,5 см в поперечнике;
- подмышечные метастазы, фиксированные к коже или к глубоким структурам подмышечной области.
Из 77 больных, имевших характеристики категорической иноперабельности, через 5 лет никто не был здоров; из 43 больных, имевших сочетания серьезных признаков, одна больная пережила 5-летний интервал без рецидива, рецидив у нее наступил через 5,5 лет. Альтернативой операции в то время была лучевая терапия и ее результаты были не хуже: средняя продолжительность жизни 77 иноперабельных больных, получавших только лучевую терапию, составила 40,4 месяца; средняя продолжительность жизни 120 иноперабельных больных, перенесших радикальную мастэктомию – 33,0 мес. Эти данные определяли тактику лечения иноперабельных больных: лучевая терапия.
Предоперационная и неоадъювантная химиотерапия
Под неоадъювантной терапией понимают системную терапию больных первично операбельным РМЖ, которую проводят перед операцией. Термин подразумевает перенос адъювантной системной терапии в предоперационный период. Термин «предоперационная терапия» восходит к 60-м годам прошлого века и относится к проведению системного противоопухолевого лечения иноперабельных больных местно распространенным РМЖ. Эффективная неоадъювантная терапия уменьшает размер опухоли и дает возможность выполнения органосохраняющей операции, берет на себя функцию адъювантной ХТ по снижению риска рецидива. Эффективная предоперационная системная терапия является ключевым этапом лечения МР РМЖ. Она позволяет выполнить радикальную операцию и дает шанс на излечение. Неэффективность предоперационной системной терапии означает инкурабельность болезни в целом. В обоих вариантах выбор терапии осуществляется по общим принципам.
У больных иноперабельным раком в свое время революционным было предложение начинать лечение с самых эффективных системных средств и добиваться перевода болезни в операбельное состояние. Существенный вклад в развитие такого лечебного подхода был сделан проф. О.В. Святухиной, ее учениками и последователями в РОНЦ им. Н.Н. Блохина РАМН. К 1975 г. учениками Ольги Владимировны Святухиной были изучены: эффективность предоперационной внутриартериальной химиотерапии тиофосфамидом и 5-фторурацилом [15]; эффективность предоперационной системной химиотерапии тиофосфамидом, 5-фторурацилом, сочетаниями тиофосфамид + 5-фторурацил и 5-фторурацил + циклофосфан [16]; эффективность предоперационной химиотерапии высокими разовыми дозами тиофосфамида [17]; особенности лечения молодых женщин с применением предоперационной химиотерапии [18]. И.Г. Соколова оценила эффективность предоперационной химиотерапии по модифицированной схеме Купера [19]. М.В. Шомова проанализировала опыт РОНЦ по лечению 1 896 больных местно-распространенным раком молочной железы за 1979-1994 гг., провела сравнение различных вариантов предоперационного лечения [7].
Случаи местно-распространенного РМЖ, относящиеся к IIIa стадии, формально являются первично операбельными, хотя по своим биологическим характеристикам их операбельность условна. Для этой категории пациентов предпочтительна тактика с предоперационной терапией, она улучшает отдаленные результаты и дает возможность выполнения органосохраняющих операций.
Необходимость начинать лечение рака IIb-IIIa стадий с химиотерапии продемонстрировали A. Fourquet et al. [20]. Авторы сравнили эффективность двух последовательностей в проведении химиотерапии и лучевой терапии у 390 больных раком T2-3N0-1M0. Половина больных получали 4 курса химиотерапии по схеме CAF, затем — местное лечение; другие 50% — сначала местное лечение, затем — химиотерапию. Четырехлетняя выживаемость первых составила 89, вторых — 80% (р = 0,046). Преимущества лечения, включающего на первом этапе химиотерапию, представили также V.F. Semiglazov и соавт. [21]: больные раком IIb-IIIa стадий (271 чел.) были рандомизированы на проведение: химиотерапии по схеме TMF (тиофосфамид, метотрексат, 5-фторурацил) в сочетании с лучевой терапией (I группа, 137 пациенток) или только предоперационной лучевой терапии (II группа, 134 пациентки). Всем была выполнена радикальная мастэктомия и проведены 4-6 курсов химиотерапии по схеме TMF. При морфологическом исследовании полная регрессия опухоли наблюдалась в 29% случаев 1-й группы и в 19% случаев 2-й группы. Пятилетняя общая выживаемость составила 86 и 78% (р> 0,05), пятилетняя безрецидивная выживаемость – 81 и 72% (р < 0,05) соответственно.
Известное положение о том, что эффективность ХТ прямо коррелирует с интенсивностью дозы химиопрепаратов при лечении диссеминированного РМЖ и при проведении адъювантной ХТ, было подтверждено и в отношении предоперационной ХТ. Так, J. Shparik [22] проведен вторичный анализ опубликованных результатов 41 исследования по предоперационной химиотерапии РМЖ. Схемы лечения включали: циклофосфан (31 исследование), 5-фторурацил (26), доксорубицин (24), эпидоксорубицин (13), метотрексат (9), винкристин (6), митоксантрон (3), цисплатин (2), митомицин С (1) и тиофосфамид (1). Исследованием выявлена прямая связь между интенсивностью дозы химиопрепаратов и эффективностью лечения.
У больных МР РМЖ (за исключением Т4d, n = 512) оценивалась целесообразность включения капецитабина в схему предоперационной ХТ. Лечение проводилось эпирубицином и доцетакселом (ET, по 75 мг/м2 каждого препарата с интервалом 21 день, на 2-й день вводился пэгфилграстим по 6 мг). Рандомизировалось дополнительное применение капецитабина по 1 000 мг/м2 дважды в день. У больных с тройным негативным РМЖ (n = 48) ПМЭ наблюдался в 47,5% случаев при проведении лечения по схеме ET-капецитабин и в 31,2% случаев при ХТ по схеме ET (различия статистически не значимы). В общей популяции больных полный морфологический эффект (ПМЭ)* был достигнут в 24,3% при включении капецитабина в схему ХТ и в 16,0% без капецитабина (р = 0,02) [23].
Схемы, включающие таксаны. G. von Minckwitz и et al. [24] представили результаты предоперационной ХТ больных РМЖ (размер опухоли 3 см или больше, N0-2, n = 250); 4 курса ХТ проводились каждые 14 дней: доксорубицин 50 мг/м2, доцетаксел 75 мг/м2, Г-КСФ с 5-го по 10-й день. Клинический эффект колебался от 77,5 до 67,5%. Полный морфологический эффект наблюдался в 9,7% случаев, еще в 2,4% остаточная опухоль была представлена только неинвазивным компонентом.
В Абердинском исследовании [25, 26] проводилась оценка роли доцетаксела в неоадъювантной ХТ РМЖ; 159 больным РМЖ T2-4N0-2M0 (78% − с Т2-3) проводилось 4 курса ХТ по схеме CVAP (циклофосфан 1 000 мг/м2, винкристин 1,5 мг/м2, но не более 2 мг; доксорубицин 50 мг/м2, преднизолон 40 мг в день в течение 5 дней) с интервалом 21 день. Больных с прогрессированием или со стабилизацией болезни (n = 55, группа 1) переводили на лечение доцетакселом 100 мг/м2, 4 курса с интервалом 21 день. Больных с полным или частичным эффектом (n = 104) рандомизировали на: продолжение ХТ по схеме CVAP, еще 4 курса с повышением дозы преднизолона до 100 мг в день в течение 5 дней (n = 52, группа 2); ХТ доцетакселом 100 мг/м2, с аналогичной дозой преднизолона (n = 52, группа 3). В 1-й группе ХТ доцетакселом была эффективна в 55%, полная морфологическая регрессия получена у 2% больных. Преимущества результатов лечения в 3-й группе по сравнению со 2-й: клиническая эффективность — 85% против 64% (р = 0,03), полная морфологическая регрессия — 31% против 15% (р = 0,06), пятилетняя БРВ 90% — против 72% (р = 0,04), частота выполнения органосохраняющих операций — 67% против 48% (р = 0,01) гранулоцитопения при проведении ХТ — 46% против 69% (р = 0,01).
C. Jackisch et al. сообщают о сравнительной оценке двух вариантов неоадъювантной ХТ 913 больных РМЖ T2-3N0-2M0 [27]. Первый вариант заключался в проведении 4 курсов ХТ доксорубицином (50 мг/м2) и доцетакселом (75 мг/м2) 1 раз в 2 недели + Г-КСФ 5 мкг/кг 5-10 дни. Во втором варианте сначала проводилось 4 курса ХТ по схеме АС, затем – 4 курса доцетакселом. При втором варианте лечения эффективность была выше, чем при первом, — 85% против 75 (р<0,001); органосохраняющие операции выполнялись чаще – 75% против 66 (р <0,005); чаще наблюдалась полная морфологическая регрессия опухоли – 14% против 7 (р < 0,001).
В исследовании В-27 Национального проекта по адъювантной терапии после операций на молочной железе и толстой кишке (National Surgical Adjuvant Breast and Bowel Project, NSABBP) 2 411 больных РМЖ T1-3N0-1M0 были рандомизированы на 3 группы: 1) проводили 4 курса ХТ по схеме АС, операция, тамоксифен 5 лет; 2) проводили 4 курса ХТ по схеме АС, 4 курса ХТ доцетакселом, операция, тамоксифен 5 лет; 3) проводили 4 курса ХТ по схеме АС, операция, 4 курса ХТ доцетакселом, тамоксифен 5 лет. Клиническая эффективность была максимальной во второй группе – 91% по сравнению с 85% в 1-й и 3-й группах (р <0,001). Частота полной морфологической регрессии опухоли во 2-й группе – 26%, в 1-й и 3-й – 14% (р <0,001). Частота полной морфологической регрессии опухоли при применении доцетаксела возрастала как у больных с РЭ(-), так и у больных с РЭ(+)-опухолями, однако, в целом она была выше при РЭ(-)-опухолях [28].
Выбору оптимального режима, сочетающего антрациклин-содержащую схему с таксанами, посвящено исследование B.E. Vriens et al. Сравнивались схемы 4АС+4Т против 6TAC [29]. Больные РМЖ — 201 чел. — (N+ и/или T3, или T4, или T2 с опухолью> 3 см) рандомизировалась на проведение предоперационной ХТ по схеме АС (доксорубицин 60 мг/м2 и циклофосфан 600 мг/м2 4 курса 1 раз в 3 недели) с последующими 4 курсами ХТ доцетакселом по 100 мг/м2, либо по схеме ТАС (6 курсов лечения доцетакселом по 75 мг/м2, доксорубицином 50 мг/м2 и циклофосфаном 500 мг/м2 1 раз в 3 недели). ПМЭ в молочной железе получен у 28% больных, получавших лечение — по схеме 4АС+4Т, и в 19% по схеме ТАС (различия статистически значимы); ПМЭ в подмышечных лимфатических узлах среди больных с N+ наблюдался в 33 и в 23% соответсвенно.
Молекулярный портрет опухоли и выбор неоадъювантной химиотерапии. Примером исследования, оценивающего предсказательные возможности молекулярно-генетической классификации РМЖ, является работа R. Rouzier et al. [30]. 82 больным РМЖ I-III стадий проводилась предоперационная ХТ паклитакселом, а затем 5-фторурацилом, доксорубицином и циклофосфаном. До начала ХТ выполняли биопсию опухоли, определяли профиль экспрессируемых генов и по ним — принадлежность опухоли к молекулярно-генетическому типу. Опухоли базального подтипа и подтипа HER2+ имели самую высокую частоту полных морфологических регрессий, — по 45%. Опухоли люминального типа — 6%, опухоли подобные нормальным клеткам, не имели ни одного случая полных морфологических регрессий. Ни один из 61 генов, ассоциировавшегося с полной морфологической регрессией опухолей базального подтипа, не ассоциировался с таким же эффектом у опухолей подтипа HER2+, что свидетельствует о разных молекулярных механизмах чувствительности опухолей к ХТ в этих подгруппах.
Люминальный тип РМЖ. Анализ публикаций по неоадъювантной ХТ, проведенный T. Cuffer et al. [31], продемонстрировал, что достижение ПМЭ у больных с РЭ(+)-опухолями возможно значительно реже (5-8%), чем у больных с РЭ(-)-опухолями (21-23%). Вместе с тем, отсутствие ПМЭ у первых не столь значительно влияет на прогноз, как у вторых. В.Ф. Семиглазовым и соавт. представлены результаты неоадъювантной терапии постменопаузальных больных гормонально-зависимым РМЖ: эффективность гормонотерапии ингибиторами ароматазы не уступала эффективности ХТ по схеме АТ [32]. Возможности предоперационной гормонотерапии будут рассмотрены в этой главе ниже.
HER2/neu + подтип РМЖ. Хорошей особенностью данного подтипа РМЖ является чувствительность к лечению трастузумабом (табл. 5).
Таблица 5
Частота полного морфологического эффекта (ПМЭ) при проведении предоперационной ХТ, включающей трастузумаб у больных с HER2+ опухолями
| Автор | n | Схема ХТ | Частота ПМЭ, % |
| B.P. Coudert et al. [36] | 33 | 6 доцетаксел | 47 |
| A.U. Buzdar et al. [34] | 42 | 4 паклитаксел и 4 FEC | 60 |
| H.S. Han et al. [35] | 32 | 4 доцетаксел + карбоплатин + ГКСФ | 40 |
| M. Untch et al. [37] | 217 | 4 EC + 4 Т | 39 |
| L. Gianni et al. [38] | 235 | AT + T+ CMF | 38(19 — ХТ без трастузумаба) |
Так, 33 больные раком II/III стадий, исключая отeчно-инфильтративную форму, получали 6 курсов ХТ доцетакселом в сочетании с трастузумабом. Прогрессирование – 3%, полный эффект — 73, частичный эффект – 23%; ПМЭ — 47% [33]. В исследовании A.U. Buzdar et al. у больных РМЖ II и IIIA стадий с HER2/neu-позитивными опухолями проводилось предоперационное лечение, включавшее 4 курса ХТ паклитакселом 225 мг/м2 и 4 курса ХТ по схеме FEC. У первых 42 больных рандомизировалось применение трастузумаба на протяжении 24 нед совместно с ХТ. Затем еще 21 больная была пролечена по той же схеме с включением трастузумаба; ПМЭ в этой группе — 60%. 3-летняя БРВ в опытной группе — 100%, в контрольной — 85,3% (р = 0,041) [34].
Применение доцетаксела и карбоплатина в уплотненном режиме (2-недельный интервал с поддержкой Г-КСФ, 4 курса) в сочетании с трастузумабом повысило частоту ПМЭ с 17 (3-недельный цикл лечения теми же препаратами) до 40% [35].
В исследовании TECHNO (Taxol Epirubicin Cyclophosphamide Herceptin NeOadjuvant) при РМЖ II-III стадий (217 больных) проанализирована эффективность ХТ по схеме EC (90/600 мг/м2 4 курса с интервалом 3 нед) и паклитакселом (175 мг/м2) в сочетании с трастузумабом (8→6 мг/кг 1 раз/3 нед, 4 курса параллельно с введением паклитаксела). Далее больных оперировали и они получали адъювантную терапию трастузумабом. Частота ПМЭ составила 39% без статистически значимых различий в зависимости от возраста, гистологической формы, степени злокачественности, критерия Т, критерия N, статуса РЭ и РП [37].
Изобретение трастузумаба революционизировало лечение HER2-позитивного РМЖ в целом и местно-распространенного рака в частности. По результатам 2 рандомизированных исследований, в которых проведение предоперационной химиотерапии сравнивалось с сочетанием «химиотерапия + трастузумаб» показано, что добавление трастузумаба увеличивает вероятность достижения полной морфологической регрессии не менее, чем в 2 раза [34, 38].
Влияние трастузумаба на выживаемость также очень выразительно. В исследовании NOAH [38] продемонстрировано увеличение 3-летней безрецидивной выживаемости до 71% при применении трастузумаба по сравнению с 56% без него (p = 0,013). В ретроспективном исследовании из Leclerc Cancer center было показано, что предоперационное применение трастузумаба повышает среднюю длительность безрецидивного периода от 3 до 9 лет [39].
Что могут дать новые анти-HER2-таргетные препараты для неоадъювантной терапии? Можно сказать, что благодаря их применению в изучении возможностей терапии HER2-позитивных опухолей, достигнут дальнейший выраженный прогресс (табл. 6).
Таблица 6
Исследования, включающие новые таргетные препараты в режим предоперационной химиотерапии HER2-позитивного РМЖ
| Исследование, номер ссылки, число больных | Схема предоперационной терапии | Клинический эффект, % | Полный морфологический эффект, % |
| GeparQuinto [40](n = 597) | 4ЕС + 4 доцетаксел + трастузумаб | x | 31,3* |
| 4ЕС + 4 доцетаксел + лапатиниб | x | 21,7* | |
| NeoALTTO, 41(n = 455) | Еженедельно паклитаксел + трастузумаб | 70,5 | 29,5** |
| Еженедельно паклитаксел + лапатиниб | 74,0 | 24,7** | |
| Еженедельно паклитаксел + Трастузумаб + лапатиниб | 80,3 | 51,3** | |
| NeoSphere, 42(n = 417) | Доцетаксел + трастузумаб | 80 | 21,5* |
| Доцетаксел + трастузумаб + пертузумаб | 88 | 39,3* | |
| Трастузумаб + пертузумаб | 68 | 11,2* | |
| Доцетаксел + пертузумаб | 71 | 17,7* |
Примечание:
*ПМЭ – отсутствие, в том числе, микроскопических проявлений болезни и в молочной железе, и в лимфатических узлах;
**ПМЭ – отсутствие инвазивного рака в молочной железе, но может быть внутрипротоковый компонент, без учeта состояния лимфатических узлов.
Часть исследования Geparquinto [40] посвящена разработке предоперационной ХТ для больных РМЖ II−III стадий с HER2-позитивными опухолями (n = 597). ХТ включала 4 курса ЕС (эпирубицин 90 мг/м2 и циклофосфан 600 мг/м2 1 раз в 3 нед) и 4 курса терапии доцетакселом по 100 мг/м2 1 раз в 3 нед. Рандомизировалось параллельное применение трастузумаба (8→6 мг/кг 1 раз в 3 нед) или лапатиниба 1 000-1 250 мг/день. Клинический эффект не описан, ПМЭ наблюдался в 31,3% при сочетании ХТ с трастузумабом и в 21,7% (см. табл. 6) при сочетании с лапатинибом (p <0,05).
В исследовании NeoAlto [41] принимали участие 99 исследовательских центров, в том числе РОНЦ им. Н.Н. Блохина РАМН. Включено 455 больных HER2-позитивным РМЖ, методом рандомизации осуществлялся выбор таргетной терапии: лапатиниб 1 500 мг в сутки (n = 154) или трастузумаб (4→2 мг/кг 1 раз/нед, n = 149) или сочетание лапатиниба (1 000 мг/сут) с трастузумабом (n = 152). Только таргетная терапия продолжалась 6 нед, затем присоединялась ХТ паклитакселом (80 мг/м2 еженедельно) еще на протяжении 12 нед. После операции больные получали 3 курса адъювантной ХТ по схеме FEC и продолжение той же таргетной терапии на протяжении 34 нед. Клиническая эффективность была примерно одинаковой в группах сравнения (см. табл. 6), частота ПМЭ была статистически значимо более высокой в группе сочетания трастузумаба с лапатинибом; различия между частотой ПМЭ в группах с лапатинибом и с трастузумабом статистически не значимы. Частота побочных эффектов 3-4 степени: диареи в группе больных, получавших лапатиниб, – 23, в группе больных, получавших трастузумаб, – 2 в группе больных, получавших лапатиниб и трастузумаб – 21; гепатотоксичность – 13, 1 и 9% соответственно; нейтропения – 16, 3 и 9% соответственно; кожная патология – 7, 3, 7% соответственно.
В ходе международного многоцентрового рандомизированного исследования NeoSphere у больных РМЖ II-III стадий с HER2-позитивными опухолями изучалась эффективность предоперационной ХТ доцетакселом в сочетании с таргетными препаратами: трастузумабом и пертузумабом. Последний так же, как и трастузумаб, является антителом к HER2, но связывается с другим участком этой рецепторной молекулы, подавляя процесс димеризации HER2 с другими рецепторами семейства – пускового механизма активации сигнального пути. Больные 417 чел. получали по 4 курса предоперационной терапии по одной из 4 схем: 1) доцетаксел + трастузумаб (n = 107); 2) доцетаксел + трастузумаб + пертузумаб (n = 107); 3) трастузумаб + пертузумаб (n = 107); 4) доцетаксел + пертузумаб (n = 96). Препараты вводили внутривенно каждые 3 нед: пертузумаб — нагрузочная доза 840 мг, поддерживающая доза 420 мг; трастузумаб — нагрузочная доза 8 мг/кг, поддерживающая доза 6 мг/кг; доцетаксел 75 мг/м2, при хорошей переносимости доза повышалась до 100 мг/м2. После операции больные получали адъювантную ХТ и трастузумаб. Применение доцетаксела с трастузумабом и пертузумабом (группа 2) сопровождалось максимальной частотой ПМЭ, различия статистически значимы (см. табл. 6), причем у больных с РЭ(-)РП- опухолями частота ПМЭ достигала 63,2% [42].
Следует отметить, что использование новых анти-HER2-препаратов (кроме трастузумаба) вне рамок клинических испытаний не разрешено.
Базальный подтип РМЖ, РЭ(-)РП-, HER2/neu-. Такая характеристика демонстрирует отсутствие традиционных молекулярных «мишеней» в опухоли и, соответственно, — отсутствие возможностей таргетной терапии, необходимость проведения ХТ в полном объеме. Следует обратить вниманиена то, что тройная негативная характеристика опухоли (РЭ-РП-HER2/neu-) характерна как для базального подтипа, так и для опухолей, подобных нормальным клеткам стромы (normal like).
В M. D. Anderson Cancer Center из 1 118 больных, получавших предоперационную ХТ, 255 (23%) имели тройную негативную характеристику опухоли: РЭ-РП- HER2neu-. Частота ПМЭ у этих больных была значительно выше, чем у остальных (22% и 11%; p = 0,034), а 3-летняя БРВ и ОВ − ниже (p <0,0001). Среди больных с ПМЭ показатели выживаемости группы с РЭ-РП-HER2/neu- опухолями и группы с другими характеристиками опухоли были равноценны. Напротив, у больных с отсутствием ПМЭ показатели выживаемости группы с РЭ-РП- HER2/neu- опухолями были значительно хуже (p <0,0001) [43].
Проведение высокодозной ХТ, включающей алкилирующие препараты, больным с РЭ(-)РП-HER2neu- негативными опухолями существенно снижает риск рецидива болезни и смерти в сравнении с традиционной антрациклин-содержащей ХТ [44]. Это совпадает с точкой зрения авторов из Institute Curie. Сравнивая эффективность 2 вариантов антрациклинсодержащей предоперационной ХТ: FAC (доксорубицин 70 мг/м² день 1-й, циклофосфан 700 мг/м² 1 день/d8, и 5FU 700 мг/м² день 1-й и 5-й) и FEC100 (эпирубицин 100 мг/м², циклофосфан 500 мг/м², и 5FU 500 мг/м² день 1) они обнаружили существенное различие в эффективности лечения больных с тройной негативной характеристикой опухоли. Частота ПМЭ у больных, получавших FAC, составила 47,4%, у больных, получавших FEC100 – 13,0%, p = 0,01. Считают, что такие опухоли чувствительны к повышению дозы циклофосфана [45].
Крупное рандомизированное исследование из Германии Geparquinto по разработке предоперационной ХТ состоит из 2 частей: для больных с HER2-негативными и для больных с HER2-позитивными опухолями. В первой части сравнивалась ХТ в сочетании с бевацизумабом или без него; 1 889 больных HER2-негативным РМЖ II−III стадий были включены в исследование. На первом этапе проводилось лечение по схеме ЕС (эпирубицин 90 мг/м2 и циклофосфан 600 мг/м2 1 раз/3 нед) ± бевацизумаб по 15 мг/кг 1 раз/3 нед. После 4 курсов оценивался эффект, больных, нечувствительных к данной ХТ, переводили на другой режим лечения. Больным с клиническим эффектом продолжали ХТ доцетакселом по 100 мг/м2 1 раз/3 нед, бевацизумаб продолжали вводить в прежнем режиме тем больным, которые были рандомизированы на его применение. После 4 курсов лечения проводилась операция, оценивали морфологический эффект. Под ПМЭ понимали отсутствие инвазивной и неинвазивной опухоли, как в молочной железе, так и в лимфатических узлах; 24 и 17% больных были нечувствительны к ХТ первой линии по схеме ЕС и ЕС+бевацизумаб соответственно. ПМЭ получен в 15,0 и в 17,5% соответственно, относительная вероятность ПМЭ при использовании бевацизумаба — 1,21 (все различия статистически не значимы). У больных с РЭ(-)РП-опухолями относительная вероятность ПМЭ 1,42; с РЭ(+) и/или РП(+)-опухолями – 1,05; при Т1-3 и N0-2 – 1,17; при Т4 или N3 – 1,7. Считают, что позитивный эффект от применения бевацизумаба может быть получен только в группе с РЭ-РП-HER2-опухолями [46].
У больных наследственным РМЖ, обусловленным мутациями генов BRCA1 и BRCA2, ХТ имеет свои особенности. Так, по данным Л.Н. Любченко и соавт. [47] предоперационная ХТ у носителей мутаций BRCA1\2 значительно эффективнее (у 75 –100% больных получена III–IV степень патоморфоза), чем при спорадическом раке (только в 8% случаев наблюдалась III–IV степень патоморфоза). Эти данные подтверждают P.O. Chappuis и соавт. [48]: после 3-4 курсов антрациклин-содержащей ХТ клинический полный эффект наблюдали у 93% больных РМЖ I-III стадий с мутациями BRCA1\2 и у 30% больных без мутаций (р = 0,0009); ПМЭ был получен в 44 и в 4% соответственно, р = 0,009. Совершенно исключительную чувствительность опухоли к препаратам платины у носителей мутаций BRCA1 описывают T. Byrski et al. [49, 50]. Из 102 больных, получавших предоперационную ХТ, ПМЭ был получен в 24%, в том числе при лечении по схеме CMF — в 7, АТ — в 8, AC или FAC – в 22, цисплатином – в 83% (у 10 из 12 больных).
В исследовании D.J. Slamon et al. убедительно показана высокая значимость амплификации топоизомеразы 2 альфа как критерия чувствительности к антрациклинам [51]. По нашим данным, эффективность предоперационной химиотерапии хорошо прогнозируется благодаря радионуклидной оценке функционирования белков, выводящих токсины из клетки опухоли (Pgp 170, MRP). Так, выраженный патоморфоз в опухоли (3−4 степени по Г.А. Лавниковой) у больных с медленным выведением радионуклида из опухоли был получен в 62, с промежуточным – в 42, с быстрым – в 0% (р <0,05) [52].
Какими препаратами лучше всего лечить больных местно-распространенный РМЖ? Вот какие рекомендации дают эксперты международной конференции в St. Gallen. Выбор терапии зависит от молекулярного подтипа опухоли. Подтип люминальный А наиболее чувствителен к гормонотерапии, однако, принадлежность к этому подтипу не означает химиорезистентность. Для предоперационной и адъвантной терапии могут применяться схемы AC, EC, FAC, FEC, AT, TAC, последовательное применение 4FAC + 4T и др. [53]. Существенный прогресс достигнут благодаря подбору препаратов в зависимости от молекулярного «портрета» опухоли. Невозможно полноценно планировать неоадъювантную терапию РМЖ, не зная экспрессии основных биологических маркеров: РЭ, РП, HER2, Ki 67. Больным с опухолями, экспрессирующими HER2, показано проведение неоадъювантной терапии, включающей трастузумаб. В качестве химиотерапевтических агентов на первом месте эксперты Конференции в Сан-Галлене назвали таксаны и антрациклины (одновременное применение трастузумаба и антрациклинов не рекомендуется из-за возможной суммации кардиотоксичности), для больных тройным негативным раком и дополнительно — алкилирующие агенты и уплотненные режимы ХТ. Больным с гормонально-зависимыми опухолями в постменопаузе возможен отказ от химиотерапии в пользу гормонотерапии ингибиторами ароматазы [53].
Предоперационная и неоадъювантная гормонотерапия
Удаление яичников или подавление их функции. Об эффективности собственно выключения яичников можно получить представление из исследования J.-C. Gazet et al., в котором изучались различные варианты неоадъювантной терапии, в частности больным репродуктивного периода с РЭ(+)-опухолями проводилась ГТ гозерелином по 3,75 мг ежемесячно. Лечение было эффективным в 54% случаев, в 15% наблюдалось прогрессирование [54].
Антиэстрогены. Во всех анализируемых исследованиях (табл. 7) оценивалась эффективность ГТ у больных РМЖ в постменопаузе с РЭ(+) и/или РП(+)-опухолями. L. Mauriac et al. изучали эффективность собственно тамоксифена [55], в других исследованиях тамоксифен получали больные, входящие в группу сравнения. Клинический эффект при 3-6-месячной длительности терапии наблюдался у 31-48% больных. Прогрессирование наблюдалось у 5-12% больных.
Таблица 7
Эффективность неоадъвантной ГТ тамоксифеном (20 мг в сутки) больных РМЖ в постменопаузе с РЭ(+) и/или РП+-опухолями
| Источник литературы | Характеристика больных | n | Длительность лечения, мес | Клиническая эффективность, % | Прогрессирование, % | ОСО, % | ПМЭ, % |
| W. Eiermann et al., 2001 (P 024) [56] | T2-4N0-2M0, исключая T4d | 170 | 4 | 36 | 12 | 35 | 3 |
| L. Mauriac et al., 2002 [55] | Т2-3T4 | 97102 | 4-6 | 4448 | 67 | 5444 | xx |
| V.F. Semiglazov et al., 2005 [57] | T2-4N0-2 | 75 | 3 | 40 | х | 20 | 3 |
| I.E. Smith et al., 2005 (IMPACT) [58] | T2-4N0-2M0, исключая T4d | 108 | 3 | 36 | 5 | 31 | x |
| L. Cataliotti et al., 2006 (PROACT) [59] | T2-4N0-2M0 | 151 | 3 | 40 | x | 30,8 | x |
Примечание: x – сведения не представлены
Ингибиторы ароматазы. Все исследования относятся к больным РМЖ в постменопаузе с РЭ(+) и\или РП(+) опухолями. В табл. 8 приведены сведения об эффективности летрозола, общая эффективность колеблется от 55 до 88%, частота прогрессирования — от 0 до 10%.
Таблица 8
Эффективность неоадъювантной ГТ летрозолом (2,5 мг в сутки) больных РМЖ в постменопаузе с РЭ(+) и\или РП(+) опухолями
| Источник литературы | Характеристика больных | n | Длительность лечения, мес | Клиническая эффектив-ность, % | Прогрессиро-вание, % | ОСО, % | ПМЭ, % |
| J.M. Dixon et al., 2001 [60] | Высокий уровень РЭ | 24 | 3 | 88 | 0 | x | 4 |
| W. Eiermann et al., 2001 (P 024) [56] | T2-4N0-2M0, исключая T4d | 154 | 4 | 55 | 8 | 45 | 1 |
| U.E. Krainick-Strobel et al., 2008 [61] | ≥T2N0M0 | 33 | 4-8 | 72 | 10 | 76 | 0 |
| J. Baselga et al., 2009 [62] | T2-4N0-2M0, исключая T4d | 132 | 4 | 59 | 10 | 36 | 1 |
Примечание: x – сведения не представлены
Максимальная эффективность получена при ГТ больных с высокими уровнями РЭ в опухоли [60]. Наибольшее число больных было включено в рандомизированное исследование Р024, эффективность летрозола сравнивалась с эффективностью тамоксифена [56]. Включались больные РМЖ T2-T4a,b,cN0-2M0, в частности с T2, — больные, у которых невозможно было выполнить органосохраняющую операцию. Исключались больные с отечно-инфильтративной формой болезни. При длительности лечения 4 мес получены доказательства существенного преимущества летрозола над тамоксифеном: общая эффективность — 55 против 36% (p <0,001), частота органосохраняющих операций — 45 против 35% (р = 0,022) соответственно.
Анастрозол был эффективен в 37-61% случаев, прогрессирование наблюдалось в 4-8% (табл. 9).
Таблица 9
Эффективность неоадъювантной ГТ анастрозолом
| Источник литературы | Характеристика больных | n | Длительность лечения, мес. | Клиническая эффективность, % | Прогрес-сирование, % | ОСО, % | ПМЭ, % |
| I.E. Smith et al., 2005 (IMPACT) [58] | Операбельный или местно-распространенный РМЖ, исключая T4d | 113 | 3 | 37 | 8 | 44 | x |
| L. Cataliotti et al., 2006 (PROACT) [59] | T2-4N0-2M0 | 163 | 3 | 50 | x | 43 | x |
| I.E. Smith et al., 2007 [63] | I-IIIb ER+в том числе: ER+PR- ER+PR+ | 79
|
4
|
61
36 72 |
4 | 38 | 0 |
Примечание: x – сведения не представлены
При стратификации по экспрессии РП было показано, что у больных с опухолями, экспрессирующими оба вида рецепторов (РЭ(+)РП+), эффект наблюдается чаще, чем при экспрессии только одного (РЭ(+)РП-) — 72 и 36% соответственно [63].
В рандомизированном исследовании IMPACT (Immediate Preoperative Anastrozole, Tamoxifen, or Combined with Tamoxifen) проводилось сравнение эффективности трехмесячной ГТ анастрозолом против тамоксифена и против сочетания этих 2 препаратов. Включались больные операбельным РМЖ или «потенциально операбельным» местно распространенным РМЖ. Включено 330 больных, в группу с анастрозолом – 113, в группу с тамоксифеном – 108, в группу с анастрозолом и тамоксифеном – 109 чел. Клинический эффект получен в 37, 36 и 39% соответственно; прогрессирование болезни – в 8, 5 и 5% соответственно; органосохраняющие операции были выполнены в 44, 31 и 24% соответственно (все различия статистически не значимы) [58].
Исследование PROACT (Pre-Operative «Arimidex» Compared to Tamoxifen) так же было рандомизированным [59]. Сравнивалась активность анастрозола (n = 228) с активностью тамоксифена (n = 223) в сочетании с ХТ или без нее у больных с РЭ(+) и/или РП+-опухолями T2-4bN0-2M0. Длительность лечения — 12 нед. Среди больных, получавших только ГТ, клинический эффект наблюдался у 50% в группе анастрозола и у 40% в группе тамоксифена (р = 0,08). Сведения о частоте прогрессирования и стабилизации болезни не приведены. Органосохраняющие операции среди больных, получавших только ГТ, чаще выполнялись в группе анастрозола, чем в группе тамоксифена: 43 и 31% соответственно (р = 0,04).
Неоадъювантная ГТ экземестаном изучалась в 3 исследованиях (табл. 10).
Таблица 10
Эффективность неоадъювантной ГТ экземестаном 25 мг/сут
| Источник литературы | Характеристика больных | n | Длительность лечения, мес. | Клиническая эффективность, % | Прогрес-сирование, % | ОСО, % | ПМЭ, % |
| V.F. Semiglazov et al., 2005 [57] | T2N1-2, T3N0-1, T4N0M0 РЭ(+) и/или РП+ | 76 | 3 | 76 | x | 36,8% | 3 |
| M. Tubiana-Hulin et al., 2007 [64] | T2-4 РЭ(+) и/или РП+ | 42 | 4 | 73 | 0 | 57% | 0 |
| G. Mustacchi et al., 2009 [65] | >70 лет T1-3N0-1M0 РЭ(+) и/или РП+ | 112 | 6 | 70 | 7 | 52% | 0 |
Примечание: x – сведения не представлены
Препарат был эффективен в 70-76%, прогрессирование наблюдалось в 0-7% случаев. В. Ф. Семиглазов и соавт. провели рандомизированное сравнение эффективности экземестана (n = 76) с тамоксифеном (n = 75). Включались больные РМЖ T2N1-2М0, T3N0-1М0, T4N0M0 с РЭ(+)-опухолями. Длительность лечения — 3 мес. Наблюдались статистически значимо лучшие результаты лечения при использовании экземестана по сравнению с тамоксифеном: общий эффект – 76% против 40% соответственно (р = 0,05); частота органосохраняющих операций – 37% против 20% соответственно (р = 0,05). Частота прогрессирования болезни не оценивалась [57].
Неоадъювантная ГТ комбинацией 2 препаратов: анастрозола и тамоксифена оказалась не более эффективной, чем ГТ каждым из них по отдельности [58] (табл. 11). Предпринята попытка неоадъювантной ГТ больных репродуктивного периода ингибиторами ароматазы [66] (табл. 11), на первом этапе функция яичников подавлялась трипторелином. После снижения уровня эстрадиола до уровня, соответствующего постменопаузе, назначался летрозол 2,5 мг/сут. Общая эффективность досигла только уровня 50%, несмотря на то, что в исследование включались больные с экспрессией и РЭ и РП. Прогрессирования болезни не наблюдали. Частота органосохраняющих операций составила 47%.
Таблица 11
Эффективность неоадъювантной комбинированной ГТ
| Источник литературы | Характеристика больных и сочетание препаратов | N | Длитель-ность лечения, мес. | Клиническая эффектив-ность, % | Прогрес-сирование, % | ОСО, % | ПМЭ, % |
| I.E. Smith et al., 2005 (IMPACT) [58] | Постменопауза, исключая T4dТамоксифен + анастрозол | 109 | 3 | 39 | 5 | 24 | X |
| R. Torrisi et al., 2007 [66] | ПременопаузаT2–T4N0–N2
РЭ(+) и РП+ Трипторелин + летрозол |
32 | 4,6-5,6 | 50 | 0 | 47 | 3 |
Тактика неоадъювантной гормонотерапии. Невысокая частота объективного эффекта от ГТ у больных репродуктивного периода [54, 66] не позволяет рекомендовать неоадъювантную ГТ как самостоятельный метод лечения этих женщин. На сегодняшний день обосновано применение неоадъювантной ГТ ингибиторами ароматазы у больных в постменопаузе с гормонально-зависимыми опухолями.
Большой вклад в разработку метода неоадъювантной ГТ и, в частности неоадъювантной ГТ ингибиторами ароматазы, сделан сотрудниками НИИ онкологии им. Н.Н. Петрова во главе с проф. В.Ф. Семиглазовым. В период становления метода существовали сомнения в необходимости такого варианта неоадъювантной терапии. В чем их суть? Во-первых, ГТ в целом, менее эффективна, чем ХТ. Так, неоадъювантная ХТ по схемам FAC, FEC, АТ эффективна в 70-90%, частота прогрессирования — в пределах 5%; ГТ РЭ(-)-позитивного диссеминированного РМЖ эффективна в 30-70% при значительной частоте прогрессирования [67-70]. Зачем проводить менее эффективную терапию, если есть более эффективная? Во-вторых, эффект от химиотерапии наступает быстрее, чем от ГТ. В первом случае уже через 3 нед в большинстве случаев видно, помогаем мы больной или нет, существует возможность своевременной модификации лечения. При проведении ГТ эффект можно ждать месяцами, при этом может быть упущено время и наступить прогрессирование болезни. Наконец, уровни РЭ и РП, по-видимому, — не достаточные критерии для точного отбора пациентов на проведение ГТ.
Полноценный ответ был получен в исследовании, проведенном в НИИ онкологии им. Н.Н.Петрова. В него было включено 239 больных в постменопаузе с гормонально-зависимым [РЭ(+) и/или РП(+)] РМЖ (T2N1-2M0, T3N0-lM0, T4N0M0). Проводилась рандомизация метода неоадъювантной терапии: ХТ по схеме АТ (доксорубицин 60 мг/м2 + паклитаксел 200 мг/м2 4 курса) либо ГТ анастрозолом 1 мг/сут, либо ГТ экземестаном 25 мг/сут. Продолжительность лечения — 3 мес. Клинический эффект был получен с равной частотой, — в 64%, как при проведении ГТ (анастрозол или экземестан), так и в группе ХТ. Клинический эффект наступал в среднем через 57 сут при проведении ГТ и через 51 сут при проведении ХТ (р> 0,05). Частота прогрессирования болезни (9% и 9%) и частота полного морфологического эффекта (3% при ГТ и 6% при ХТ) не различались статистически значимо. Органосохраняющие операции выполнялись несколько чаще у больных после ГТ, чем после ХТ (33% против 24% соответственно; р = 0,058). В группе ХТ наблюдались побочные эффекты (алопеция – в 79%, нейтропения 3-й и 4-й степени – в 33%, нейропатия 2-й степени – в 30%), которых не было у больных в группе ГТ [71]. Дополнительно сравнение было проведено у больных с высокой экспрессией РЭ (более 6 баллов по шкале Allred или больше 120 фмоль/мг для биохимического метода); клиническая эффективность ГТ составила 70, ХТ – 60%; органосохраняющие операции выполнялись в 43% у первых и в 24% у вторых (р = 0,054). Таким образом, было показано, что в определенной группе больных [постменопауза, РЭ(+) и/или РП(+)] ГТ ингибиторами ароматазы не менее эффективна, чем ХТ по схеме АТ, и легче переносима.
С 2009 г. в рекомендациях экспертов Конференции по лечению РМЖ в Сан-Галлене присутствуют предложения по проведению неоадъювантной ГТ больным в постменопаузе с выраженной гормональной зависимостью опухоли [53, 72].
В качестве показателей выраженной гормональной зависимости опухоли, обеспечивающей не менее 70% клинической эффективности, используются повышенный уровень РЭ> 30 фмоль/мг [73], более 6 баллов по шкале Allred или более120 фмоль/мг для биохимического метода [71] и сочетание позитивности по двум видам рецепторов, — РЭ(+) и РП+ [67-70].
Антиэстрогены или ингибиторы ароматазы? Проведение неоадъювантной ГТ рекомендовано у больных в постменопаузе. Перед началом терапии нужно убедиться в постменопаузальном статусе либо по данным анамнеза, либо с использованием лабораторных тестов (концентрация эстрадиола, ЛГ и ФСГ). Такая детализация несущественна при назначении антиэстрогенов, но необходима при назначении ингибиторов ароматазы. Ингибиторы ароматазы не подавляют продукцию эстрогенов в яичниках. Механизм их действия — блокирование периферического (в жировой ткани, печени, опухоли и т.д.) превращения андрогенов в эстрогены и снижение концентраций эстрадиола, эстрона, эстрон-сульфата в крови. У женщин в перименопаузе снижение концентрации эстрогенов может привести к повышению гонадотропной активности гипофиза, возобновлению овариально-менструального цикла и прекращению противоопухолевого действия препарата.
Хотя подбор пациентов по высокому уровню РЭ и позитивности по 2 видам рецепторов обеспечивает не менее 70% эффекта при лечении тамоксифеном [67-70], в целом эффективность ингибиторов ароматазы выше, это доказано в рандомизированных исследованиях по неоадъювантной ГТ летрозолом [56] и экземестаном [57]. Различия в эффективности особенно существенны для больных с гиперэкспрессией HER2neu.
Очевидно, что чем дольше лечить «чувствительную» болезнь, тем больше будет эффект; с другой стороны, чем дольше лечить, тем больше вероятность дождаться резистентности болезни и прогрессирования. I.E. Smith et al [63] получили клинический эффект в 61% случаев при проведении ГТ анастрозолом в течение 16 нед, против 37% при ГТ в течение 12 нед [58]. В рекомендациях международных экспертов по проведению неоадъювантной системной терапии предлагается проведение ГТ в течение 4-8 мес, для исключения применения неэффективных препаратов рекомендуется ранняя оценка эффекта, — через 6-9 нед от начала лечения [74]. Можно добавить личную рекомендацию проф. В.Ф. Семиглазова: через 6 нед от начала ГТ оценить эффективность терапии клинически и по данным УЗИ. При появлении тенденции к эффекту лечение продолжать, если же за этот период опухоль сохранила свои размеры или появилась тенденцию к росту, лечение нужно менять. Такую тактику можно предложить и на весь период неоадъювантной ГТ: контроль каждые 6 нед, в случае прекращения нарастания эффекта лечение меняется (операция, если достигнут достаточный эффект, или другая системная терапия).
Оценка операбельности после терапии
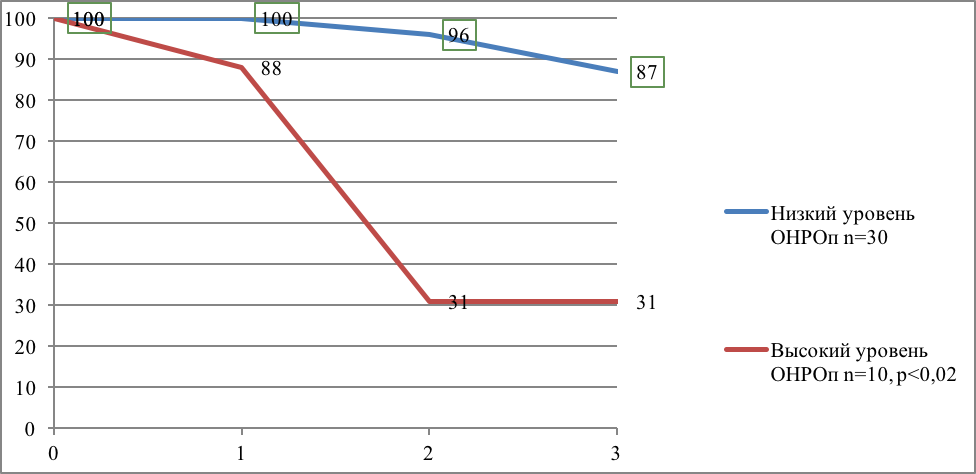
Когда можно сказать, что болезнь переведена в операбельное состояние? Когда в результате системной терапии имеется сочетание технической резектабельности, уменьшения размеров опухолевых проявлений (отека кожи, первичной опухоли, метастазов в лимфатических узлах) и отсутствия появления новых метастазов. Для оценки операбельности достаточно полезно повторно оценить пролиферативную активность клеток опухоли. Наш старый опыт с использованием относительного накопления 32Р в опухоли в качестве показателя пролиферативной активности ее клеток подчёркивает важность такой оценки. Относительное накопление 32Р в опухоли после проведения предоперационной химиотерапии было определено у 40 больных РМЖ III стадии. Все больные имели частичный эффект или стабилизацию, были прооперированы и получали адъювантную системную терапию. В последующем больные были прослежены, процесс развития местно-регионарного рецидива оценен с помощью построения кривых выживаемости без местно-регионарного рецидива актуариальным методом в группах больных с разным уровнем ОНРОп (рис. 1).
Рисунок 1. Выживаемость без местно-регионарного рецидива больных РМЖ III стадии в зависимости от уровня пролиферативной активности клеток в остаточной опухоли
В группе с высокой пролиферативной активностью клеток остаточной опухоли местно-регионарный рецидив за 2 года развился почти у 70% больных. Если вспомнить формулировку C. Haagensen, то следует признать, что эта группа больных иноперабельна.
Итак, больные местно-распространенным РМЖ, имеющие после системной терапии клиническое улучшение и низкую пролиферативную активность клеток опухоли операбельны; больные местно-распространенным РМЖ, имеющие после системной терапии клиническое улучшение и высокую пролиферативную активность клеток опухоли остаются иноперабельными и нуждаются в модификации системной терапии.
Особенности операций
Какой объeм операций может выполняться при местно-распространeнном РМЖ? По нашему опыту, это зависит преимущественно от исходного статуса болезни. «Снижение стадии» болезни в результате предоперационной терапии — это временное явление, которое нужно вовремя использовать для выполнения последующих этапов лечения, в частности – операции. Опасным заблуждением является представление о том, что «снижение стадии» после эффективной системной терапии при отечной форме болезни позволит выполнить органосохраняющую операцию.
Такие клинические признаки опухолевого поражения лимфатической системы кожи как отек кожи или внутрикожные сателлиты, определяемые при первом осмотре больной, диктуют необходимость выполнения мастэктомии с тотальным иссечением кожи даже в случаях полного клинического эффекта от предоперационной терапии. В случаях отсутствия исходного отека кожи и сателлитов возможны варианты сохранения кожи молочной железы, например, выполнение кожесохраняющей мастэктомии. При отсутствии исходного отека кожи, сателлитов и общих противопоказаний к органосохраняющим операциям, такие операции возможны при достаточном сокращении объема опухоли.
Выполнение технологии биопсии сигнального лимфатического узла у больных местно-распространенным РМЖ пока находится в стадии методической разработки. В настоящее время нашим предложением остается выполнение подмышечной лимфаденэктомии I-III уровней во всех случаях местно-распространенного РМЖ.
Таблица 12
Объем операции на молочной железе при местно-распространенном раке
| Исходный статус | Статус после терапии | Объем операции на молочной железе | |||
| резекция | кожесохраняющая МЭ | МЭ без тотального удаления кожи | МЭ с тотальным удалением кожи | ||
| T4N0-3M0Имеется отек кожи и/или сателлиты | Уменьшение или исчезновение проявлений болезни | — | — | — | + |
| T0-2N2M0, T3N1-2M0, T4N0-2M0,T0-4N3M0
Отсутствуют отек кожи и сателлиты, наличие мультицентричности или внутриорганных метастазов, или значительного внутрипротокового распространения |
Уменьшение или исчезновение проявлений болезни | — | + | + | — |
| T0-2N2M0, T3N1-2M0, T4N0-2M0,T0-4N3M0
Отсутствуют отек кожи, сателлиты, мультицентричность, внутриорганные метастазы и значительное внутрипротоковое распространение |
Уменьшение или исчезновение проявлений болезни | + | + | + | — |
Является ли первичная реконструкция молочной железы безопасной при МР РМЖ? Этому было посвящено наше ретроспективное исследование результатов операций, выполненных в 1992-2002 гг. Его рабочая гипотеза была основана на опасениях, того что «избыточный объем операции может активировать «спящие» опухолевые клетки, снизить иммунитет, и, как результат, — спровоцировать рецидив болезни». Сравниваемые группы включали больных, которым выполнялась модифицированная радикальная мастэктомия с первичной реконструкцией молочной железы (124 больные) или выполнялись операции без первичной реконструкции (n = 379). Группы равноценны по частоте основных клинических прогностических факторов. Примерно ¼ в каждой из групп составляли больные МР РМЖ. Из-за опасности конфликта силиконового импланта с последующей лучевой терапией при МРРМЖ выполнялась реконструкция TRAM-лоскутом на 2 мышечных ножках.
При средней прослеженности 5 лет частота местного рецидива составила 1,6% в группе с первичной реконструкцией и 1,7% в группе модифицированной радикальной мастэктомии без реконструкции. Частота рецидива болезни в целом также не отличалась статистически значимо. Анализ факторов, влияющих на рецидив болезни, показывает преобладающее влияние таких известных факторов, как критерии T, N, возраст, проведение химиотерапии. Факт проведения первичной реконструкции не оказывал статистически значимого влияния на процесс рецидивирования опухоли. Таким образом, первичная реконструкция молочной железы может безопасно выполняться больным местно-распространенным РМЖ [75].
Однако, чем больше объем операций, тем вероятнее осложнения их заживления, особенно при сопутствующем сахарном диабете, ожирении и длительном курении. У этих больных длительное заживление раны может отсрочить проведение адъювантной ХТ, лучевой терапии. Поэтому для этой категории больных предпочтительнее отказ от первичной реконструкции.
Альтернативная тактика, т.е. выполнение на первом этапе операции, не претендующей на радикализм (паллиативной операции), показана в случаях осложненного рака. Абсолютными показаниями к паллиативной мастэктомии являются кровотечение из распадающейся опухоли и абсцедирование опухоли. Относительные показания: распад опухоли, изъязвление. Паллиативную мастэктомию при этом желательно выполнять как радикальную, возможно выполнение операции по Холстеду. Это пример альтернативной тактики. Распад и кровотечение из опухоли создают другую ситуацию, в которой актуальным является лечение осложнения опухоли. Начало лечения с операции создает возможность для проведения лечения в полном объеме, химиотерапии и лучевой терапии (рис. 2).
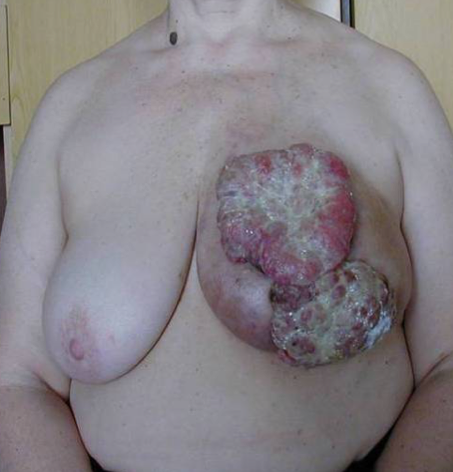
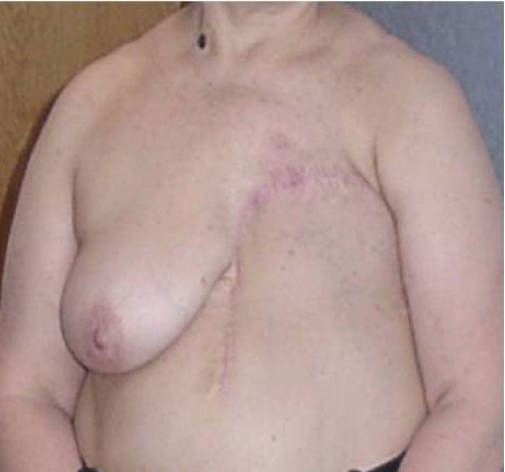 Рисунок 2. Больная МР РМЖ, осложненным распадом опухоли. До операции и через год после нее
Рисунок 2. Больная МР РМЖ, осложненным распадом опухоли. До операции и через год после нее
Некоторые прогностические факторы и адъювантная терапия
Ответ опухоли на неоадъювантную химиотерапию сам по себе является сильным фактором прогноза. По нашим данным, появление отдаленных метастазов зависело от клинической эффективности предоперационной ХТ. В первые 2 года метастазы возникали у 4% больных, леченных с эффектом; у 38% больных, леченных со стабилизацией; и у 100% больных, имевших местное прогрессирование опухоли [76]. По данным H.M. Kuerer et al [77], степень выраженности морфологического эффекта от системной терапии также является очень сильным фактором прогноза. У больных РМЖ с ПМЭ и в молочной железе и в лимфатических узлах 5-летняя БРВ составила 87% — значительно больше, чем у больных с отсутствием ПМЭ (58%, p <0,01).
Guitu et al. представили ретроспективный анализ предоперационной ХТ больных РМЖ II-III стадий (n = 461), проводившейся в Онкологическом центре Ж.Ф. Леклерка (Дижон, Франция). 125 больных были с HER2-позитивными опухолями, половина из них получала предоперационно трастузумаб. Факторами, повышающими вероятность достижения ПМЭ, были Т (при Т1 более вероятно, чем при Т2, Т3 и Т4); степень злокачественности (при 2-й степени злокачественности в 4,02; а при 3-й — в 9,99 раза более вероятно, чем при 1-й степени); гистологическая форма (при дольковом раке примерно в 4 раза менее вероятно, чем при протоковом, относительная вероятность 0,23); молекулярный тип опухоли [при РЭ-РП-HER2- в 7,64; а при HER2+ в 11,17 раза вероятнее, чем при РЭ(+) и/или РП(+) опухолях], применение трастузумаба (в 8,77 раза вероятнее, чем без трастузумаба). Несмотря на низкую частоту ПМЭ при гормонально-зависимых раках [РЭ(+) и/или РП(+)], у этих больных наблюдалась самая большая продолжительность жизни без рецидива с медианой 9,0 лет, у больных с РЭ-РП-HER2- опухолями – 4,4 года, у больных с HER2-позитивными опухолями – 7,8 лет. В последней группе больных предоперационное применение трастузумаба ассоциировалось с более длительной продолжительностью жизни без рецидива, медиана – 8,65 года по сравнению с 3,24 года у больных, не получавших трастузумаб перед операцией (р = 0,002). Медиана общей продолжительности жизни самая низкая при РЭ-РП-HER2- опухолях (6,4 года), при гормонально-зависимых опухолях – 13,1, при HER2-позитивных опухолях – 15,1 года (за счет применения таргетных препаратов) [39].
В исследовании TECHNO (217 больных) отсутствие ПМЭ после ХТ, даже на фоне продолжающейся адъювантной терапии трастузумабом, было самым сильным фактором, достоверно повышающим вероятность рецидива болезни по сравнению с больными, достигшими ПМЭ (относительный риск — 2,73); вторым по влиянию на безрецидивную выживаемость был критерий «Т» по системе TNM (при T4 относительный риск 2,06 по сравнению с больными, имевшими Т1-3). Факторами, влияющими на общую выживаемость (в порядке убывания значимости) были: возраст (старше 40 лет хуже, чем моложе 40 лет), наличие ПМЭ, Т, статус РЭ и РП [78].
Cortazar et al. провели мета-анализ 12 рандомизированных исследований по неоадъювантной ХТ, число анализированных больных — 13125. Показано, что достижение полного морфологического эффекта имеет большое позитивное прогностическое значение. Сочетание ПМЭ в молочной железе должно дополняться ПМЭ в лимфатических узлах, наличие остаточной опухоли в лимфатических узлах ослабляет позитивный прогностический эффект. Этого нельзя сказать об остаточной опухоли в молочной железе в виде внутрипротокового компонента, т. е., если выражаться символами системы TNM, ypT0ypN0 равноценно ypTisypN0. Достижение ПМЭ (ypT0/isypN0) улучшает БРВ (относительный риск = 0,48) и ОВ (относительный риск = 0,36) по сравнению с больными, у которых ПМЭ не достигнут. ПМЭ редко наблюдали у больных с опухолями низкой степени злокачественности и гормонально-позитивными (7%) и наиболее часто при следующих подтипах опухолей: высокой степени злокачественности и гормонально-позитивными (16%), тройными негативными (34%), гормонально-позитивными с HER2+ (30%), гормонально-негативными с HER2+ (50%). Чем более агрессивным был подтип опухоли, тем большим было различие БРВ между больными с ПМЭ и без него, относительный риск составил: для высокой степени злокачественности и гормонально-позитивных опухолей — 0,27; для гормонально-позитивных опухолей с HER2+ — 0,58; для гормонально-негативных с HER2+ — 0,25; для тройных негативных опухолей — 0,24. Влияние ПМЭ ограничивалось перечисленными вариантами РМЖ [79].
Tokudome et al. отмечают, что несмотря на более высокую частоту ПМЭ у больных с РЭ-РП-HER2- и HER2-позитивными опухолями, у них чаще развиваются метастазы в головной мозг, в том числе и у больных, имевших ПМЭ [80]. По данным S.P. Li et al., факторами, влияющими на отдаленные результаты у больных после предоперационной ХТ, являются уровень Ki 67 в остаточной опухоли, состояние регионарных лимфатических узлов и экспрессия РП [81]. В наблюдении T. Tanei et al. самый лучший прогноз имели больные с ПМЭ после предоперационной ХТ, худший – больные с высокими значениями Ki 67 в остаточной опухоли и промежуточный – больные с низкими значениями Ki 67 в остаточной опухоли [82]. По мнению N. Wada et al., прогностическое значение Ki 67 до предоперационной ХТ и после нее различно. Исходный уровень Ki 67 – это фактор, предсказывающий эффективность ХТ, при высоком исходном уровне Ki 67 ПМЭ наблюдался в 23%, а при низком – в 9%. Уровень Ki 67 в остаточной опухоли – фактор прогноза выживаемости, так, при высоком уровне Ki 67 5-летняя выживаемость составила 51%, а при низком – 81% (р <0,01) [83].
Выводы
- Местно-распространенный рак молочной железы – «большая», системная и быстро метастазирующая болезнь. Обладает выраженной способностью к местно-регионарному рецидивированию.
- Наиболее успешная лечебная тактика слагается из предоперационной системной терапии, операции, лучевой терапии и адъювантной системной терапии.
- Дальнейшее улучшение результатов лечения возможно посредством повышения эффективности системной терапии.
- Органосохраняющие операции больным местно-распространенным раком молочной железы могут проводиться при отсутствии признаков исходного опухолевого поражения лимфатической системы кожи (отек, сателлиты) и других противопоказаний, после эффективной системной терапии.
- Наличие признаков исходного опухолевого поражения лимфатической системы кожи (отек, сателлиты) молочной железы означает необходимость выполнения модифицированной радикальной мастэктомии после проведения эффективной системной терапии.
- Первичная реконструкция молочной железы больным местно-распространенным раком может проводиться при отсутствии факторов, отягчающих заживление ран (сахарный диабет, ожирение, длительное курение).
- Рекомендуемый объем лимфаденэктомии при местно-распространенном раке молочной железы – I-III уровни.
- Выполнение паллиативной мастэктомии оправдано у больных с распадом опухоли и/или кровотечением из опухоли.
Список литературы:
- Портной С.М. Рак молочной железы (факторы прогноза и лечение). Дисс. д.м.н. М., 1997.
- Портной С.М. Функциональное состояние и заболевания печени у больных раком молочной железы. Дисс. к.м.н. М., 1981.
- Кутателадзе Т.О., Морошкин И.Б., Портной С.М. Динамика метастазирования рака молочной железы в костях. Советская медицина. — 1989. — № 11. — с. 16-19.
- Baillet F., Rozec C., Ucla L. et al. Treatment of locally advanced breast cancer without mastectomy: 5- and 10-yr results of 135 tumors larger than 5 cm treated by external-beam therapy, brachytherapy and neoadjuvant chemotherapy // Pisa Symposia in Oncology. Breast Cancer: From Biology to Therapy. October 19-21, 1992. Pisa, P. 22.
- McLaren D.B., Keen C.W., Webster D.W., Barrett-Lee P.J. 15 years of neoadjuvant chemotherapy in advanced carcinoma of the breast // Br. J. Cancer. 1995. Vol. 72, Suppl. 25 P. 4.
- Buric M., Filipovic S., Projevic M., Veselinovic S. Metastatic dissemination in the inflammatory breast cancer (IBC) // Eur. J. Cancer. 1996. Vol. 32A, Suppl. 2. P. 8-22.
- М.В.Шомова. Местнораспространенный рак молочной железы (лечение и факторы прогноза) Дисс. … д.м.н., Москва, 1999.
- С.М.Портной, К.П.Лактионов, А.И.Барканов, и др. Опыт лечения больных прогностически отягощённым местно-распространённым раком молочной железы. IV ежегодная российская онкологическая конференция Москва,21-23 ноября 2000 г. Москва, 2000. С.57-59.
- Bristol IJ, Woodward WA, Strom EA, et al. Locoregional treatment outcomes after multimodality management of inflammatory breast cancer. Int J Radiat Oncol Biol Phys. 2008;72(2):474-84.
- Dawood S, Broglio K, Yang W-T, et al. Prognostic significance of HER2 status in women with inflammatory breast cancer. // 30th Annual SAN ANTONIO BREAST CANCER SYMPOSIUM . December 13–16, 2007. Breast Cancer Research and Treatment VOL. 106. – Suppl. 1. — Abstr. 6005.
- Mehta RS, Schubbert T, Jackson D, et al. Pathologic complete response following paclitaxel (cremophor or albumin bound) + carboplatin ± trastuzumab± bevacizumab sequenced after in vivo chemosensitivity-adapted dose-dense doxorubicin-cyclophophamide in inflammatory breast cancer. // 30th Annual SAN ANTONIO BREAST CANCER SYMPOSIUM. December 13–16, 2007. -Breast Cancer Research and Treatment. — 2007. -VOL. — 106. — Suppl. 1. — Abstr. 5066.
- Haagensen C., Stout A.P. Carcinoma of the breast. II — Criteria of operability. Ann. Surg. -1943. — 118. — 859-870 & 1032-1051.
- C.D.Haagensen. Diseases of the breast. W.B.Sauders Company. Philadelphia and London, 1956, 751 p.
- Haagensen C. Diseases of the breast. 1965.
- Гольдман Б.Г. Внутриартериальная регионарная химиотерапия в комплексном лечении местно распространённого рака молочной железы. Дисс. … канд. мед. наук.1966.
- Гольдман Б.Г. Непосредственные результаты предоперационной химиотерапии рака молочной железы. // Вопросы онкологии. — 1975. — N 10. — С. 19-21.
- Викманис У.Э. Лечение первично распространённого рака молочной железы. Дисс. … канд. мед. наук. М., 1975.
- Полевая Е.Б. Лечение распространённого рака молочной железы у молодых женщин. Тезисы симпозиума, Л. 1975. С. 95-96.
- Соколова И.Г. Предоперационная полихимиотерапия в комплексном лечении местно-распространённого рака молочной железы. Дис. … канд. мед. наук. М., 1983.
- Fourquet A., Campana F., Scholl S. et al. Primary chemotherapy or primary radiotherapy: a possibility to preserve the breast in large tumors // International Congress of Radiation Oncology 1993, June 21-25. Kyoto. — 1993. — P. 112.
- Semiglazov V.F., Topuzov E.E., Bavli J.L., et al. Primary (neoadjuvant) chemotherapy and radiotherapy compared with primary radiotherapy alone in stage IIb-IIIa breast cancer // Ann. Oncol. — 1994. — Vol. — 5. — N 7. — P. 591-595.
- Shparik J. Breast cancer in 1980: meta-analysis of dose intensity (neoadjuvant chemotherapy) // Eur. J. Cancer. 1996. Vol. 32A, Suppl. 2. P. 8-10.
- Steger G.G., Barrios C., O`Shaughnessy J., et al. Review of capecitabine for the treatment of triple-negative early breast cancer. Cancer Research, 2010, v. 70, N 24, Suppl. 2, PD01-03.
- von Minckwitz G., Costa S.D., Raab G., Blohmer J.U., Eidtmann H., Hilfrich J., Merkle E., Jackisch C., Gademann G., Tulusan A.H., Eiermann W., Graf E., Kaufmann M. German Preoperative Adriamycin-Docetaxel and German Adjuvant Breast Cancer Study Groups. Dose-dense doxorubicin, docetaxel, and granulocyte colony-stimulating factor support with or without tamoxifen as preoperative therapy in patients with operable carcinoma of the breast: a randomized, controlled, open phase IIb study // J. Clin. Oncol. 2001. Vol. 19, N 15. P. 3506-3515.
- Smith I.C., Heys S.D., Hutcheon A.W. et al. Neoadjuvant chemotherapy in breast cancer: significantly enhanced response with docetaxel // J. Clin. Oncol. 2002. Vol. 20, N 6. P. 1456-1466.
- Hutcheon A.W., Heys S.D., Sarkar T.K. et al. Docetaxel primary chemotherapy in breast cancer: a five year update of the Aberdeen trial // Breast Cancer Res. Treat. 2003. Vol. 82, Suppl. 1. S9. Abstr. 11.
- Jackisch C., von Minckwitz G., Raab G. et al. Primary endpoint analysis of the Geparduo-study: preoperative chemotherapy (PCT) comparing dose-dense versus sequential adriamycin/docetaxel combination in operable breast cancer (T2-3, N0-2, M0) // Breast Cancer Res. Treat. 2002. Vol. 76. S90. Abstr. 152.
- Bear H.D., Anderson S., Brown A. et al. The effect on tumor response of adding sequential preoperative docetaxel to preoperative doxorubicin and cyclophosphamide: preliminary results from National Surgical Adjuvant Breast and Bowel Project Protocol B-27 // J. Clin. Oncol. 2003. Vol. 21. N 22. P. 4165-4174.
- Vriens B.E., Van de Vijver K.K., Boetes C. et al. Sequential versus upfront intensified neoadjuvant chemotherapy in patients with large resectable or locally advanced breast cancer (INTENS), first results from a phase III study of the Dutch breast cancer trialists` group (BOOG). 33 SABCS 2010, р1-11-10.
- Rouzier R, Perou CM, Symmans WF, et al. Breast cancer molecular subtypes respond differently to preoperative chemotherapy. Clin Cancer Res. 2005;11(16):5678-5685.
- Cufer T., Pajk B., Borstnar S. Individualised systemic treatment. 5-th European breast cancer conference. Nice – France 21-25 March 2006. Abstract book. Abst. 237.
- V. Semiglazov, A. Kletsel, V. Semiglazov et al. Primary endocrine therapy vs chemotherapy in postmenopausal ER-positive breast cancer patients. 5-th European breast cancer conference. Nice – France 21-25 March 2006. Abstract book. Abst. 238.
- Hurley J, Doliny P, Reis I, et al. Docetaxel, cisplatin, and trastuzumab as primary systemic therapy for human epidermal growth factor receptor 2-positive locally advanced breast cancer. J Clin Oncol. 2006 Apr 20;24(12):1831-1838.
- AU Buzdar, V Valero, NK Ibrahim, et al. Neoadjuvant Therapy with Paclitaxel followed by 5-Fluorouracil, Epirubicin, and Cyclophosphamide Chemotherapy and Concurrent Trastuzumab in Human Epidermal Growth Factor Receptor 2–Positive Operable Breast Cancer: An Update of the Initial Randomized Study Population and Data of Additional Patients Treated with the Same Regimen Clinical Cancer Research 2007 13, 228-233.
- Han HS, Doliny P, Blaya M, et al. Dose-dense docetaxel, carboplatinum and trastuzumab as neoadjuvant therapy for human epidermal growth factor receptor-2 – positive stage II and III breast cancer. 30th Annual SAN ANTONIO BREAST CANCER SYMPOSIUM . December 13–16, 2007. Breast Cancer Research and Treatment VOL. 106, Supplement 1, Abstr. 5060.
- Coudert BP, Arnould L, Moreau L, et al. Pre-operative systemic (neo-adjuvant) therapy with trastuzumab and docetaxel for HER2-overexpressing stage II or III breast cancer: results of a multicenter phase II trial. Ann Oncol. 2006 Mar;17(3):409-14.
- Untch M., Fasching P.A., Konacny G.E., et al. Pathological complete response after neoadjuvant chemotherapy + trastuzumab treatment predicts survival and detects a patient subgroup at high need for improvement of anti-HER2 therapy. Three year median follow-up data of the TECHNO trial. 33 SABCS 2010, P1-11-03.
- Gianni L, Eiermann W, Semiglazov V, et al. Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2-positive locally advanced breast cancer (the NOAH trial): a randomised controlled superiority trial with a parallel HER2-negative cohort. Lancet. 2010;375(9712):377-84.
- Guitu S., Arnould L., Gauthier M., et al. Pathologic response and survival after neoadjuvant therapy for breast cancer: a 30-year sigle-center study. 33 SABCS 2010, Р1-11-02.
- Untch M., Loibl S., Bischoff J., et al. Lapatinib vs trastuzumab in combination with neoadjuvant antracycline-taxane-based chemotherapy: primary efficacy endpoint analysis of the GEPARQUINTO study (GBG 44). 33 SABCS 2010, S3-1.
- Baselga J., Bradbury I., Eidtmann H., et al. First results of the NeoALTTO trial (BIG 01-06/EGF 106903): a phase III, randomized, open label, neoadjuvant study of lapatinib, trastuzumab, and their combination plus paclitaxel in women with HER2-positive primary breast cancer. 33 SABCS 2010, S3-3.
- Gianni L., Pienkowski T., Im Y.-H. et al. Neoadjuvant pertuzumab (P) and trastuzumab (H): antitumor and safety analysis of a randomized phase II study (‘NeoSphere’). 33 SABCS 2010, S3-2.
- Liedtke C, Mazouni C, Hess KR, et al. Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer. J Clin Oncol. 2008 Mar 10;26(8):1275-81.
- 18. Rodenhuis S, Bontenbal M, van Hoesel QG, et al., Efficacy of high-dose alkylating chemotherapy in HER2/neu-negative breast cancer. Ann Oncol. 2006;17(4):588-596.
- Le Tourneau C, Dettwiler S, Laurence V, et al. 47% pathologic complete response rate to anthracyclinesbased associated with high cyclophosphamide doses neoadjuvant chemotherapy in basal-like and triple negative breast cancer patients. 30th Annual SAN ANTONIO BREAST CANCER SYMPOSIUM . December 13–16, 2007. Breast Cancer Research and Treatment VOL. 106, Supplement 1, Abstr. 4010.
- von Minckwitz G., Eidtmann H., Rezai M., et al. Neoadjuvant chemotherapy with or without bevacizumab: primary efficacy endpoint analysis of the GEPARQUINTO study (GBG 44). 33 SABCS 2010, S4-6.
- Любченко Л.Н., Поспехова Н.И., Шабанов М.И. и др. Влияние герминальных мутаций гена BRCA 1 на фенотипическое проявление рака молочной железы. Тезисы IV Российской Онкологической Конференции Москва 21-23 ноября 2000. c.84-85.
- Chappuis P.O., Goffin J., Wong N., et al. A significant response to neoadjuvant chemotherapy in BRCA1/2 related breast cancer. J Med Genet. 2002; 39(8):608-610.
- Byrski T., Huzarski T., Dent R., et al. Response to neoadjuvant therapy with cisplatin in BRCA1-positive breast cancer patients. Breast Cancer Res Treat. 2009; 115(2):359-363.
- Byrski T., Gronwald J., Huzarski T., et al. Pathologic complete response rates in young women with BRCA1-positive breast cancers after neoadjuvant chemotherapy. J Clin Oncol. 2010; 28(3):375-379.
- Slamon DJ, Mackey J, Robert N, et al. Role of anthracycline-based therapy in the adjuvant treatment of breast cancer: efficacy analyses determined by molecular subtypes of the disease. // 30th Annual SAN ANTONIO BREAST CANCER SYMPOSIUM. December 13–16, 2007. Breast Cancer Research and Treatment. — 2007. — VOL. — 106. –Suppl. 1. — Abst13.
- Portnoj S.M., Shiryaev S.V., Odjarova A.A., Anurova O.A., Laktionov K.P., Rjabchikov D.A. 99m Tc-MIBI elimination by a tumor as predictor of pathological effect of chemotherapy in locally advanced breast cancer patients. // 7th European Breast Cancer Conference. 24-27 March 2010, Barcelona, Spain. — EJC. — 2010. — V.8. -N 3, Suppl. -p.71.
- A.Goldhirsch, W.C.Wood, A.S.Coates et al. Strategy for subtypes – dealing with the diversity of breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011. Annals of Oncology. 2011;22(8):1736-1747.
- Gazet JC, Coombes RC, Ford HT, et al. Assesssment of the effect of pretreatment with neoadjuvant therapy on primary breast cancer. Br J Cancer. 1996; 73(6):758-762.
- Mauriac L, Debled M, Durand M, Floquet A, Boulanger V, Dagada C, Trufflandier N, MacGrogan G. Neoadjuvant tamoxifen for hormone-sensitive non-metastatic breast carcinomas in earl y postmenopausal women. Ann Oncol. 2002 Feb;13(2):293-8.
- Eiermann W., Paepke S, Appfelstaedt J, Llombart-Cussac A, Eremin J, Vinholes J, Mauriac L, Ellis M, Lassus M, Chaudri-Ross HA, Dugan M, Borgs M; Letrozole Neo-Adjuvant Breast Cancer Study Group. Preoperative treatment of postmenopausal breast cancer patients with letrozole: A randomized double-blind multicenter study. Ann Oncol. 2001; 12 (11):1527-1532.
- V. Semiglazov, A. Kletsel, V. Semiglazov, E. Zhiltzova, V. Ivanov, G. Dashyan, A. Bozhok, O. Melnikova, R. Paltuev and L. Berstein. Exemestane (E) vs tamoxifen (T) as neoadjuvant endocrine therapy for postmenopausal women with ER+ breast cancer (T2N1–2, T3N0–1, T4N0M0). Journal of Clinical Oncology, 2005 ASCO Annual Meeting Proceedings. Vol 23, No 16S (June 1 Supplement), 2005: Abstr. 530.
- Smith I.E., Dowsett M, Ebbs SR, Dixon JM, Skene A, Blohmer JU, Ashley SE, Francis S, Boeddinghaus I, Walsh G; IMPACT Trialists Group. Neoadjuvant treatment of postmenopausal breast cancer with anastrozole, tamoxifen, or both in combination: the Immediate Preoperative Anastrozole, Tamoxifen, or Combined with Tamoxifen (IMPACT) multicenter double-blind randomized trial. J Clin Oncol. 2005 Aug 1;23(22):5108-16.
- Cataliotti L, Buzdar AU, Noguchi S, Bines J, Takatsuka Y, Petrakova K, Dube P, de Oliveira CT. Comparison of anastrozole versus tamoxifen as preoperative therapy in postmenopausal women with hormone receptor-positive breast cancer: the Pre-Operative «Arimidex» Compared to Tamoxifen (PROACT) trial. Cancer. 2006 May 15;106(10):2095-103.
- Dixon J.M., Love CD, Bellamy CO, Cameron DA, Leonard RC, Smith H, Miller WR. Letrozole as primary medical therapy for locally advanced and large operable breast cancer. Breast Cancer Res Treat. 2001;66(3):191-199.
- Krainick-Strobel U.E., W. Lichtenegger, D.Wallwiener, et al. Neoadjuvant letrozole in postmenopausal estrogen and/or progesterone receptor positive breast cancer: A phase IIb/III trial to investigate optimal duration of preoperative endocrine therapy. BMC Cancer. 2008; 8: 62.
- Baselga J, Semiglazov V, van Dam P, Manikhas A, Bellet M, Mayordomo J, Campone M, Kubista E, Greil R, Bianchi G, Steinseifer J, Molloy B, Tokaji E, Gardner H, Phillips P, Stumm M, Lane HA, Dixon JM, Jonat W, Rugo HS. Phase II randomized study of neoadjuvant everolimus plus letrozole compared with placebo plus letrozole in patients with estrogen receptor-positive breast cancer. J Clin Oncol. 2009 ;27(16):2630-2637.
- Smith I. E., G. Walsh, A. Skene, et al. A Phase II Placebo-Controlled Trial of Neoadjuvant Anastrozole Alone or With Gefitinib in Early Breast Cancer. J Clin Oncology, 2007, 25, No 25,: pp. 3816-3822.
- Tubiana-Hulin M., Becette V, Bieche I, Mauriac L, Romieu G, Bibeau F, Macgrogan G, Bourgeois H, Chollet P, Defrance R, Spyratos F. Exemestane as neoadjuvant hormonotherapy for locally advanced breast cancer: results of a phase II trial. Anticancer Res. 2007;27(4C):2689-96.
- Mustacchi G., M. Mansutti, C. Sacco, et al. Neo-adjuvant exemestane in elderly patients with breast cancer: a phase II, multicentre, open-label, Italian study. Ann. Onc., April 1, 2009; 20(4): 655 — 659.
- Torrisi R., V Bagnardi, G Pruneri, et al. Antitumour and biological effects of letrozole and GnRH analogue as primary therapy in premenopausal women with ER and PgR positive locally advanced operable breast cancer. British Journal of Cancer (2007) 97, 802–808.
- McGuire WL. Steroid Receptors in Human Breast Cancer. Cancer Res. 1978, 38, 4289-4291.
- Wittliff JL. Steroid-hormone receptors in breast cancer. Cancer. 1984;53(3 Suppl):630-643.
- McGuire WL, Chamness GC, Fuqua SA. Estrogen receptor variants in clinical breast cancer. Mol Endocrinol. 1991;5(11):1571-1577.
- Elledge RM, Green S, Pugh R, Allred DC, Clark GM, Hill J, Ravdin P, Martino S, Osborne CK. Estrogen receptor (ER) and progesterone receptor (PgR), by ligand-binding assay compared with ER, PgR and pS2, by immuno-histochemistry in predicting response to tamoxifen in metastatic breast cancer: a Southwest Oncology Group Study. Int J Cancer. 2000;89(2):111-117.
- Semiglazov VF, Semiglazov VV, Dashyan GA, Ziltsova EK, Ivanov VG, Bozhok AA, Melnikova OA, Paltuev RM, Kletzel A, Berstein LM. Phase 2 randomized trial of primary endocrine therapy versus chemotherapy in postmenopausal patients with estrogen receptor-positive breast cancer. Cancer. 2007;110(2):244-54.
- Goldhirsch, J. N. Ingle, R. D. Gelber, et al. Thresholds for therapies: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2009. Ann Oncol. 2009;20 (8):1319-29.
- Bezwoda WR, Esser JD, Dansey R, Kessel I, Lange M. The value of estrogen and progesterone receptor determinations in advanced breast cancer. Estrogen receptor level but not progesterone receptor level correlates with response to tamoxifen. Cancer. 1991;68(4):867-72.
- Kaufmann M, von Minckwitz G, Bear HD, et al. Recommendations from an international expert panel on the use of neoadjuvant (primary) systemic treatment of operable breast cancer: new perspectives 2006. Ann Oncol. 2007;18(12):1927-34.
- Портной С.М., С.Н. Блохин, Х.С.Арсланов и др. Оценка онкологического риска одномоментных реконструктивных операций при раке молочной железы. Вопросы онкологии, 2008, №6, 720-723.
- Д.В.Репетюк, С.М.Портной, В.Н.Богатырев, К.П.Лактионов Количественные цитологические факторы прогноза при раке молочной железы II и III стадий в оценке эффективности неоадъювантной химиотерапии. V съезд Ассоциации клинических цитологов. Москва, 2003. Программа и тезисы съезда. «Новости клинической цитологии России», 2003, том 7, №№ 1-2, тез. 37.
- Kuerer HM, Newman LA, Smith TL, et al. Clinical course of breast cancer patients with complete pathologic primary tumor and axillary lymph node response to doxorubicin-based neoadjuvant chemotherapy. J Clin Oncol. 1999;17(2):460-469.
- Untch M., Fasching P.A., Konacny G.E., et al. Pathological complete response after neoadjuvant chemotherapy + trastuzumab treatment predicts survival and detects a patient subgroup at high need for improvement of anti-HER2 therapy. Three year median follow-up data of the TECHNO trial. 33 SABCS 2010, P1-11-03.
- Cortazar P, Zhang L, Untch M, et al. Meta-analysis Results from the Collaborative Trials in Neoadjuvant Breast Cancer (CTNeoBC). 33 SABCS 2010 S1-11.
- Tokudome N., Ito Y., Takahashi S., et al. Triple negative or HER2 positive subtypes of breast cancer groups are chemo-sensitive, but higher rate of brain metastasis contributes poorer prognosis. 33 SABCS 2010, P1-11-13.
- Li S.P., Burcombe R., Beresford M.J., et al. Predicting outcome with Ki67 in primary breast cancer in the neoadjuvant setting. 33 SABCS 2010, PD07-04.
- Tanei T., Shimomura A., Shimazu K. et al. Prognostic significance of Ki67 index after neoadjuvant chemotherapy for human breast cancer. 33 SABCS 2010, Р1-11-19.
- Wada N., Asaga S., Yamauchi C., et al. Breast cancer patients with neoadjuvant chemotherapy have a different clinical significance of the Ki-67 expression before and after the treatment. 33 SABCS 2010, P3-10-28.